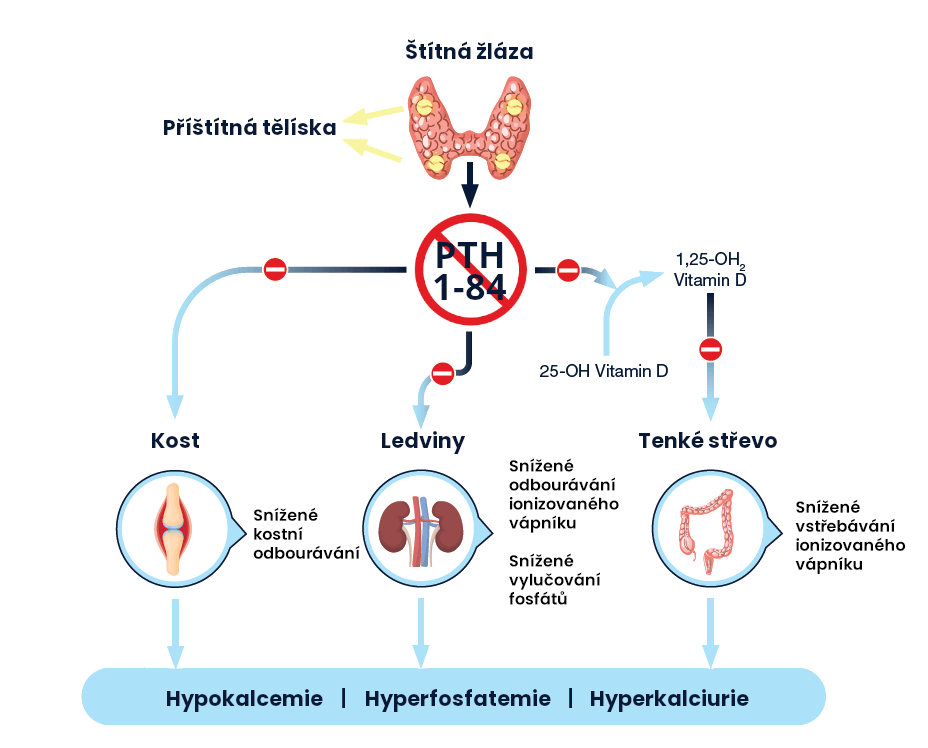
Endogenní parathormon (PTH) je vylučován příštítnými tělísky jako polypeptid z 84 aminokyselin. PTH působí prostřednictvím buněčných povrchových receptorů na parathormon, které jsou přítomné v kosti, ledvinách a nervové tkáni.1
Parathormon má celou řadu zásadních fyziologických funkcí, které zahrnují jeho ústřední úlohu při regulaci hladiny kalcia a fosfátů v séru v pevně daných hladinách, regulaci vylučování kalcia a fosfátu ledvinami, aktivaci vitaminu D a udržování normálního kostního obratu.1
Nedostatek parathormonu ve svém důsledku vede k nízkým hladinám sérového vápníku – tzv. hypokalcemii, zvýšeným hladinám fosfátů v séru – tzv. hyperfosfatemii a zvýšenému množství vápníku v moči – tzv. hyperkalciurii.2-4
Natpar je produkovaný E. coli pomocí rekombinantní DNA technologie a je identický s 84 aminokyselinovou sekvencí endogenního lidského parathormonu.1 N-terminální fragment je nezbytný pro jeho biologickou aktivitu. Studie naznačují, že C-terminální fragment má protichůdný zpětnovazebný účinek na působení molekuly v celé délce, a tím zabraňuje nadměrnému zvýšení vápníku.2
Struktura parathormonu

PTH (1-84) je hlavním regulátorem homeostázy kalcia v plazmě. V ledvinách zvyšuje PTH (1-84) renální tubulární reabsorpci kalcia a podporuje vylučování fosfátů.1 Nedostatek parathormonu vede ke sníženému zpětnému vstřebávání vápníku v ledvinách, ke zvýšenému zadržování fosfátů a ke snížené syntéze aktivního vitaminu D v ledvinách. V důsledku toho je významně narušené vstřebávání vápníku ze střeva.3
Hypoparatyreóza je spojena s celou řadou příznaků. Patří mezi ně fyzické příznaky, jako je bolest svalů nebo křeče, kognitivní příznaky, jako je mozková mlha, a emoční příznaky, jako je úzkost nebo strach.5,6
Minerální nerovnováha způsobená chronickou hypoparatyreózou je spojena s rizikem dlouhodobých komplikací, zahrnující pokles funkce ledvin, ledvinové kameny, usazování vápníku v ledvinové tkáni a ve velkých krevních cévách a v mozku.1-6
Reference: 1. SPC přípravku Natpar, poslední revise textu duben 2020. 2. Murray TM, et al. Endocr Rev. 2005;26(1):78–113. 3. Levine MA. Endocr Dev. 2003;6:14–33. 4. Shoback DM, et al. J Clin Endocrinol Metab. 2016;101(6):2300–12. 5. Bollerslev J, et al. Eur J Endocrinol. 2015;173(2):G1–20. 6. Hadker N, et al. Endocr Pract. 2014;20(7):671–9.
Přípravek Natpar je indikován jako přídatná léčba dospělých pacientů s chronickou hypoparathyreózou, kteří nejsou dostatečně kontrolováni samostatnou standardní léčbou.1
Standardní léčba chronické hypoparatyreózy spočívá především v denním užívání různých dávek doplňků vápníku a aktivního vitaminu D. To může udržovat hladinu vápníku na téměř normální úrovni, ale neřeší to základní nedostatek parathormonu, což znamená, že minerální homeostáza zůstává narušena a pacienti nadále trpí projevy nemoci. Navíc vysoké dávky vápníku a aktivního vitaminu D mohou vést k hyperkalciurii a usazeninám vápníku v ledvinách.2-4
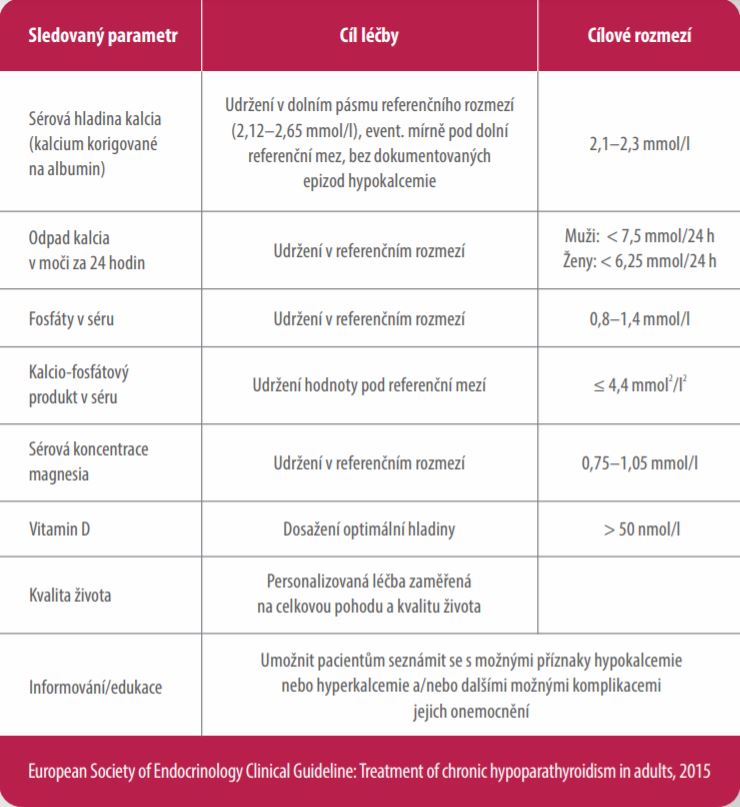
Cílem léčby přípravkem Natpar je dosažení kontroly kalcémie, a tak snížení příznaků hypoparathyreózy. Jedná se o jediný léčivý přípravek, který může pomoci dané skupině pacientů, která je definovaná Českou endokrinologickou společností.1
DEFINICE PACIENTA S CHRONICKOU HYPOPARATYREÓZOU,
který není dostatečně kontrolován samostatnou standardní léčbou a u kterého by měla být zvážena substituční léčba rhPTH (1–84).1,3
Dosažení jednoho či více následujících kritérií Vám může pomoci identikovat nedostatečně kontrolovaného pacienta.1-4
SLEDOVANÁ KRITÉRIA
Současná léčba1-4

Denní perorální dávka převyšuje:
· 2,5 g kalcia NEBO 1,5 µg kalcitriolu nebo 3 µg alfakalcidolu
Biochemické parametry1-4

· Nemožnost udržet optimální hladinu sérového kalcia v dolním pásmu referenčního rozmezí případně mírně pod dolní referenční mez, bez dokumentovaných epizod hyperkalcemie

· Opakující se hyperkalciurie > 7,5 mmol/24 h u mužů a > 6,25 mmol/24 h u žen
· Snížení glomerulární filtrace (GF) < 1,0 ml/s/1,73 m² (< 60 ml/min/1,73 m²)

· Hyperfosfatemie A/NEBO kalcio-fosfátový produkt > 4,4 mmol2/l2
Život ohrožující symptomy spojené s hypoparatyreózou1

Broncho/laryngospasmus
Arytmie
Generalizované křeče
Jiné parametry1-4

· Komorbidity jako je nefrolitiáza nebo o nefrokalcinóza dle zobrazovacích metod
· Prokazatelná klinicky závažná malabsorpce GIT
Výrazně omezená kvalita života z důvodu přítomnosti závažných symptomů hypokalcemie1-5

Reference: 1. Kršek M, Čáp J, et al. Doporučený postup České endokrinologické společnosti pro diagnostiku a léčbu primární hyperparathyreózy a hypoparathyreózy. Vnitř Lék 2021, 67(Suppl.A). 2. Khan AA, et al. Eur J Endocrinol. 2019; 180(3):P1–22. 3. Bilezikian JP, et al. J Clin Endocrinol Metab. 2016(10);101:2313–24. 4. Brandi ML, et al. J Clin Endocrinol Metab. 2016;101(6):2273–83. 5. Tabacco G, Tay Y-KD, Cusano NE, et al. Quality of life in hypoparathyroidism improves with rhPTH(1-84) throughout 8 years of therapy. J Clin Endocrinol Metab. 2019;104:2748-2756.
Datum přípravy: březen 2021 · C-APROM/CZ/NATP/0019
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku
- Natpar je vhodný pro podávání samotným pacientem. Každá dávka se musí podávat jako subkutánní injekce jednou denně, střídavě do každého stehna.1
- Pacienti musí být proškoleni předepisujícím lékařem nebo zdravotnickým odborným personálem o správném způsobu aplikace.1
4 různá dávkování – stejná cena

Léčba přípravkem Natpar vyžaduje nastavení a zahájení léčby, úpravu dávky a sledování
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku.

NASTAVENÍ A ZAHÁJENÍ LÉČBY PŘÍPRAVKEM NATPAR1
PŘED zahájením léčby
- Ujistěte se o dostatečném stavu zásobení 25-OH vitaminem D
- Ověřte, že sérové kalcium a magnesium jsou v referenčním rozmezí
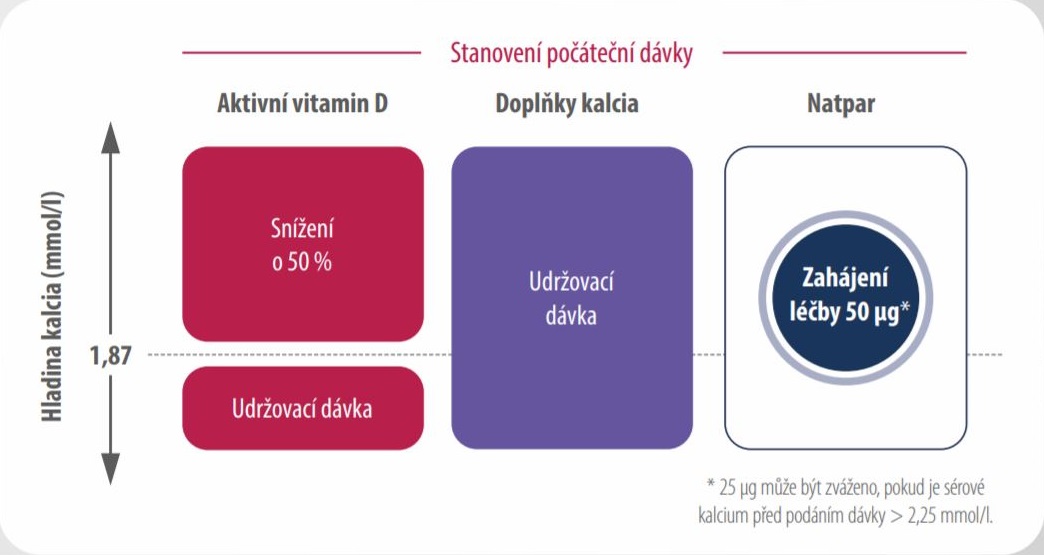
- Dle hodnoty sérového kalcia se rozhodněte o počáteční dávce přípravku Natpar a aktivního vitaminu D
ZAHÁJENÍ léčby
Počáteční dávka přípravku Natpar: léčba se zahajuje dávkou 50 µg jednou denně subkutánní injekcí do jednoho ze stehen. Pokud je před podáním dávky sérové kalcium >2,25 mmol/l, je možné zvážit podání počáteční dávky 25 μg.- hladina sérového kalcia před dávkou je v rozmezí 2,0–2,25 mmol/l
- snížení nebo přerušení suplementace aktivním vitaminem D
- dostatečná suplementace kalcia
Měření požadované před zahájením léčby přípravkem Natpar
- Aktivní vitamin D: Pokud je sérové kalcium před podáním dávky > 1,87 mmol/l a pacient užívá aktivní vitamin D, snižte jeho dávku o 50 %.
- Kalcium: U pacientů, kteří užívají doplňky kalcia, udržujte jejich dávku.

ÚPRAVA DÁVKY PŘÍPRAVKU NATPAR V PRŮBĚHU LÉČBY1
I. Úprava dávky PO zahájení léčby
Kontrolní odběry v rozmezí 2–5 dnů po první aplikaci přípravku Natpar
- Změřte sérové kalcium před podáním pravidelné dávky (24 hodin po poslední aplikaci), a pokud je hladina sérového kalcia < 1,87 mmol/l nebo > 2,55 mmol/l zopakujte měření následující den.
- Upravte dávku aktivního vitaminu D nebo doplňku kalcia (nebo obou) na základě sérové hladiny kalcia a Vašeho klinického hodnocení (tzn. příznaky hypokalcemie nebo hyperkalcemie).
II. Úprava dávky V PRŮBĚHU léčby (titrace)
Kontrolní odběry po 14–28 dnech od první aplikace přípravku Natpar
Dávka přípravku Natpar se může zvýšit o 25 µg každé 2–4 týdny, do dosažení maximální denní dávky 100 µg. Snížení dávky na minimálních 25 µg může proběhnout kdykoli. Pro optimalizaci léčby se doporučuje změřit hladinu sérového kalcia korigovanou na albumin 8–12 hodin po podání přípravku Natpar (maximální hodnota). Před plánovaným zvýšením dávky přípravku Natpar je doporučeno opakované měření hladiny sérového kalcia korigovaného na albumin před a po aplikaci přípravku Natpar.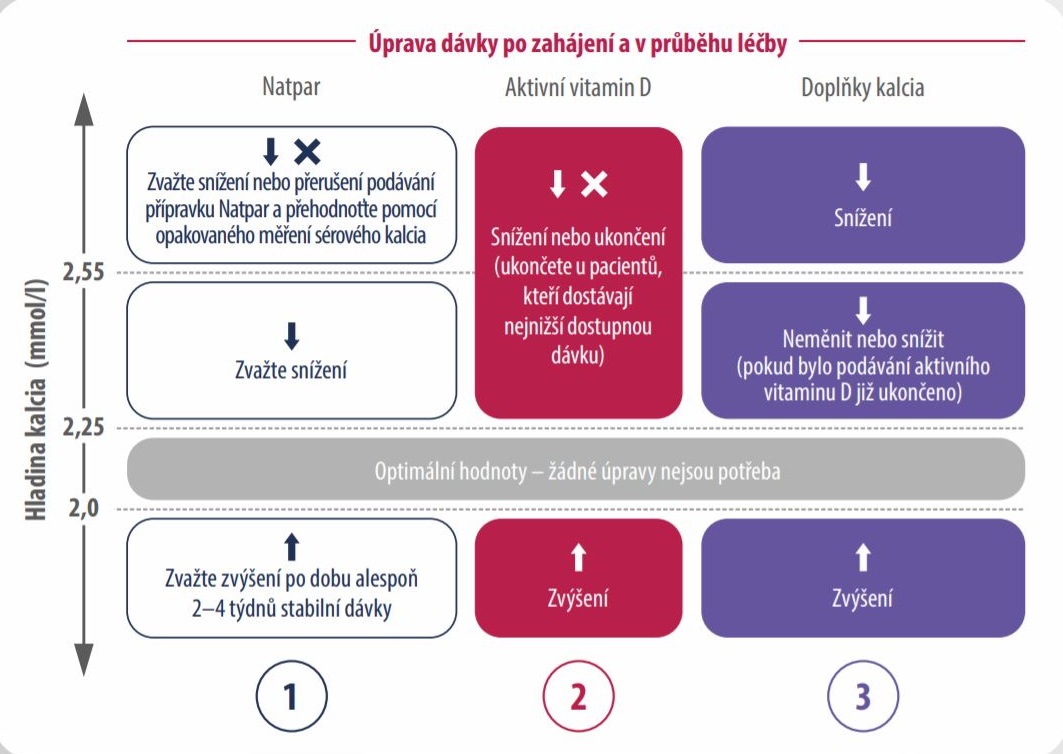
Data z klinických studií ukazují, že u více jak poloviny pacientů léčených přípravkem Natpar je dávka upravena na maximální možnou dávku 100 µg denně.2
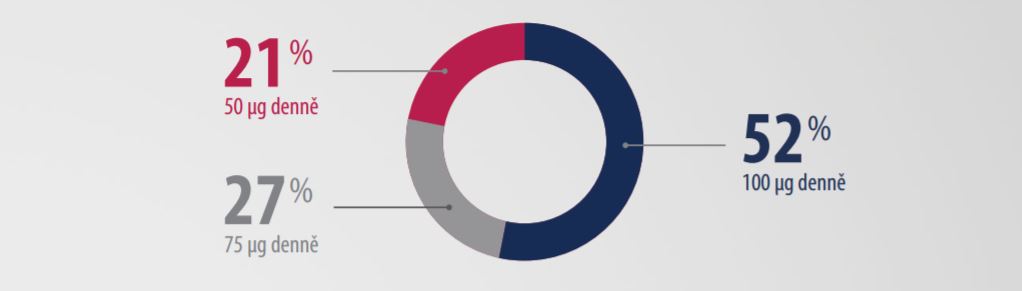
Natpar podávaný jednou denně zajišťuje stabilní hladinu kalcia po dobu 24 hodin1,3

Dočasné nebo trvalé přerušení léčby přípravkem Natpar musí být doprovázeno monitorováním hladiny kalcia v séru a zvýšením exogenního kalcia a/nebo podle potřeby zdrojů aktivního vitaminu D.

DLOUHODOBÉ SLEDOVÁNÍ PACIENTA
Doporučené pravidelné sledování:1-6

U pacientů s chronickou hypoparatyreózou se mohou častěji vyskytnout tyto komorbidity:

Česká a evropská endokrinologická společnost doporučuje individualizovanou léčbu a sledování pacientů s chronickou hypoparatyreózou4,7
Cílem léčby přípravkem Natpar je dosažení kontroly kalcemie, a tak snížení příznaků hypoparatyreózy společně s optimalizací parametrů kalcio-fosfátového metabolismu.1-7
Cíle léčby u pacientů s chronickou hypoparatyreózou4,5
Reference: 1. SPC přípravku Natpar, poslední revize textu duben 2020. 2. Mannstadt M, Clarke BL, et al. Efficacy and safety of recombinant human parathyroid hormone (1-84) in hypoparathyroidism (REPLACE): a double-blind, placebo-controlled, randomised, phase 3 study. Lancet Diabetes Endocrinol -2013;1(4):275-283. 3. Clarke BL, Kay Borg J, et al. Pharmacokinetics and pharmacodynamics of subcutaneous recombinant parathyroid hormone (1-84) in patients with hypoparathyroidism: an open-label, single dose, phase I study. Clin Ther 2014;36(5):722-36. 4. Bollerslev J, Rejnmark L, et al. European Society of Endocrinology Clinical Guideline: Treatment of chronic hypoparathyroidism in adults. Eur J Endocrinol 2015;173(2):G1–20. 5. Khan AA, et al. Standards of care for hypoparathyroidism in adults. Eur J Endocrinol 2018;180(3):P1-22. 6. Válek M, Roblová L, et al. Hypocalcaemic cardiomyopathy: a description of two cases and a literature review. ESC Heart Failure 2020; 7:1291-1301. 7. Kršek M, Čáp J, et al. Doporučený postup České endokrinologické společnosti pro diagnostiku a léčbu primární hyperparathyreózy a hypoparathyreózy. Vnitř Lék 2021, 67(Suppl.A).
Datum přípravy: březen 2021 · C-APROM/CZ/NATP/0019
Zahájení a průběh léčby LP Natpar
Pro pacienty se vzácným endokrinním onemocněním, chronickou hypoparatyreózou, kterým byla ošetřujícím lékařem doporučena léčba LP Natpar, jsme připravili pacientský program s názvem Hypopara program. Cílem programu je pomoci pacientům a jejich rodinám porozumět jejich onemocnění a zajistit, aby každodenní injekční podávání se stalo jednoduchou a běžnou součástí jejich života.

Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace
Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů
(hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA
programu
dle instrukcí
v letáčku. Registraci je nutné
udělat v okamžiku,
kdy bude znám termín prvního
podání LP Natpar u ošetřujícího
endokrinologa včetně proškolení.


Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku
na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem
pomoci s první
samostatnou aplikací
v domácím prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem
připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace
v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti
v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění
na konec
exspirace pera.
Zahájení a průběh léčby LP Natpar
Pro pacienty se vzácným endokrinním onemocněním, chronickou hypoparatyreózou, kterým byla ošetřujícím lékařem doporučena léčba LP Natpar, jsme připravili pacientský program s názvem Hypopara program. Cílem programu je pomoci pacientům a jejich rodinám porozumět jejich onemocnění a zajistit, aby každodenní injekční podávání se stalo jednoduchou a běžnou součástí jejich života.

Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů
(hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT



Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA programu dle instrukcí v letáčku. Registraci je nutné udělat v okamžiku, kdy bude znám termín prvního podání LP Natpar u ošetřujícího endokrinologa včetně proškolení.


Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku
na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace v rámci HYPOPARA programu s cílem
pomoci s první samostatnou
aplikací v domácím
prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem
připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace
v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti
v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění
na konec
exspirace pera.
Pro zobrazení časové osy otočte vaše mobilní zařízení
Reference: 1. SPC přípravku Natpar, poslední revize textu duben 2020. 2. Bollerslev J, Rejnmark L, et al. European Society of Endocrinology Clinical Guideline: Treatment of chronic hypoparathyroidism in adults. Eur J Endocrinol 2015;173(2):G1-20.
C-APROM/CZ/NATP/0013 • Datum přípravy: únor 2021
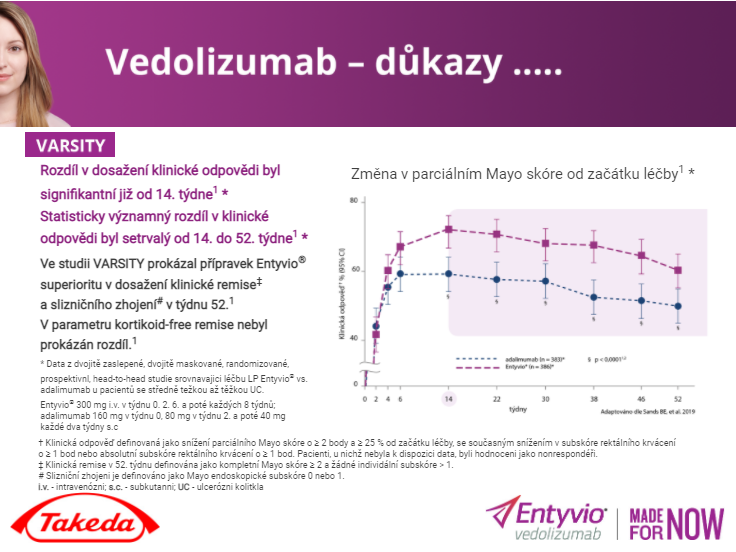
Mohlo by Vás zajímat
NATPAR
Zkrácené informace o léčivém přípravku
▼ Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8 SPC.
Název přípravku: Natpar 25 mikrogramů/dávka prášek a rozpouštědlo pro injekční roztok; Natpar 50 mikrogramů/dávka prášek a rozpouštědlo pro injekční roztok; Natpar 75 mikrogramů/dávka prášek a rozpouštědlo pro injekční roztok; Natpar 100 mikrogramů/dávka prášek a rozpouštědlo pro injekční Složení: Jedna dávka obsahuje po rekonstituci 25/50/75/100 mikrogramů hormonum parathyroidum (rDNA)* v 71,4 mikrolitrech roztoku. Jedna zásobní vložka obsahuje 350/700/1050/1400 mikrogramů hormonum parathyroidum (rDNA). *Parathormon (rDNA) produkovaný E. coli pomocí rekombinantní DNA technologie je identický se sekvencí 84 aminokyselin endogenního lidského parathormonu. Indikace: Přípravek Natpar je indikován jako přídatná léčba dospělých pacientů s chronickou hypoparathyreózou, kteří nejsou dostatečně kontrolováni samostatnou standardní léčbou. Dávkování a způsob podání: Zahajte léčbu 50 mikrogramy jednou denně subkutánní injekcí do stehna (střídejte stehna každý den). Pokud je před podáním dávky sérové kalcium > 2,25 mmol/l, je možné zvážit podání počáteční dávky 25 mikrogramů. U pacientů užívajících aktivní vitamin D snižte jeho dávku o 50 %, pokud je sérové kalcium před podáním dávky nad 1,87 mmol/l. Udržujte doplňkovou dávku kalcia. Změřte sérovou koncentraci kalcia během 2 až 5 dnů před podáním dávky. Pokud je sérová hladina kalcia před dávkou pod 1,87 mmol/l nebo nad 2,55 mmol/l, mělo by se měření opakovat následující den. Upravte dávku aktivního vitamínu D nebo doplňku kalcia nebo obou na základě sérové hladiny kalcia a klinického hodnocení. Úpravy se mají opakovat, dokud nebudou cílové hladiny sérového kalcia před dávkou v rozsahu 2,0 – 2,25 mmol/l, aktivní vitamín D bude ukončen a doplněk kalcia je dostatečný pro splnění denních požadavků. Během titrace musí být monitorována koncentrace sérového kalcia. Dávka přípravku Natpar se může zvýšit o 25 mikrogramů přibližně každé 2 až 4 týdny, do maximální denní dávky 100 mikrogramů. K titraci dávky dolů na minimum 25 mikrogramů může dojít kdykoliv. Pokyny k úpravě dávky po úvodním období – viz SPC. Přípravek Natpar je vhodný pro podávání samotným pacientem jako subkutánní injekce jednou denně střídavě do každého stehna. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. U pacientů, kteří podstupují nebo dříve podstupovali radioterapii skeletu, s malignitami skeletu nebo kostními metastázami, kteří mají zvýšené výchozí riziko vzniku osteosarkomu (pacienti s Pagetovou chorobou kostí nebo dědičnými poruchami), s nevysvětleným zvýšením kostní alkalické fosfatázy a s pseudohypoparathyreózou. Zvláštní upozornění a opatření pro použití: Monitorování pacientů během léčby: Sérové hladiny kalcia před dávkou a v některých případech po dávce musí být během léčby přípravkem Natpar sledovány. Hyperkalcemie: často se objevovala během titračního období. V případě závažné hyperkalcemie (> 3,0 mmol/l nebo nad horní hranici normy s příznaky), zvažte hydrataci a dočasné zastavení podávání přípravku Natpar, kalcia a aktivního vitamínu D, dokud se sérové kalcium nevrátí do normálního rozsahu. Hypokalcemie: Riziko závažné hypokalcemie je nejvyšší po odložení podání, vynechání nebo náhlém vysazení přípravku Natpar, může se ale vyskytnout kdykoli. Souběžné použití se srdečními glykosidy: Hyperkalcemie z jakékoliv příčiny může predisponovat k toxicitě digitalis. Závažná porucha funkce ledvin nebo jater: Používat s opatrností u pacientů se závažnou poruchou ledvin nebo jater. Použití u mladých dospělých: Používat s opatrností u mladých dospělých pacientů s otevřenými epifýzami, protože tito pacienti mohou být vystaveni zvýšenému riziku vzniku osteosarkomu. Použití u starších pacientů: Klinické studie nezahrnovaly dostatečný počet subjektů ve věku ≥ 65 let pro stanovení, zda je odpověď u těchto subjektů odlišná od mladších subjektů. Tachyfylaxe: Účinek přípravku Natpar se může po čase u některých pacientů snížit. Urolitiáza: U pacientů s aktivní nebo nedávnou urolitiázou je nutno používat přípravek Natpar s opatrností vzhledem k jeho potenciálu tento stav zhoršovat. Hypersenzitivita: Po uvedení na trh byly hlášeny hypersenzitivní reakce, které mohou zahrnovat anafylaxi, dyspnoi, angioedém, kopřivku, vyrážku atd. Interakce: Kombinované použití přípravku Natpar a srdečních glykosidů může pacienty predisponovat k toxicitě digitalisu, pokud vznikne hyperkalcémie. Současné používání přípravku Natpar s bisfosfonáty se nedoporučuje. Fertilita, těhotenství a kojení: Údaje o podávání přípravku Natpar těhotným ženám nejsou k dispozici. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky. Není známo, zda se přípravek Natpar vylučuje do lidského mateřského mléka. Dostupné farmakologické údaje u zvířat prokázaly vylučování přípravku Natpar do mléka. Neexistují žádné údaje u člověka o vlivu přípravku Natpar na plodnost. Studie na zvířatech nenaznačují žádnou poruchu plodnosti. Nežádoucí účinky: Nejčastější nežádoucí reakce byly hyperkalcemie, hypokalcemie a jejich související klinické projevy, zahrnující bolesti hlavy, průjem, zvracení, parestezie, hypestezie a hyperkalciurie. Ostatní nežádoucí účinky – viz SPC. Předávkování: Může způsobit hyperkalcémii. Těžká hyperkalcémie může být život ohrožující stav vyžadující neodkladnou lékařskou péči a pečlivé monitorování. Podmínky uchovávání: Uchovávejte v chladničce (2 °C – 8 °C). Chraňte před mrazem. Uchovávejte zásobní vložky v držáku v krabičce, aby byly chráněny před světlem. Podmínky uchovávání po rekonstituci – viz SPC. Držitel rozhodnutí o registraci: Shire Pharmaceuticals Ireland Limited, Block 2 & 3 Miesian Plaza, 50 – 58 Baggot Street Lower, Dublin 2, Irsko. Registrační čísla: EU/1/15/1078/001-004. Poslední revize SPC: 04/2020.
Výdej léčivého přípravku je vázán na lékařský předpis. Léčivý přípravek není hrazen z prostředků veřejného zdravotního pojištění. Před předepsáním se seznamte s úplným zněním Souhrnu údajů o přípravku.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na SÚKL nebo společnosti Takeda emailem na AE.CZE@takeda.com. Podezření na nežádoucí účinky hlaste také podle národních legislativních požadavků.
▼ Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8 SPC.
Název přípravku: Natpar 25 mikrogramů/dávka prášek a rozpouštědlo pro injekční roztok; Natpar 50 mikrogramů/dávka prášek a rozpouštědlo pro injekční roztok; Natpar 75 mikrogramů/dávka prášek a rozpouštědlo pro injekční roztok; Natpar 100 mikrogramů/dávka prášek a rozpouštědlo pro injekční Složení: Jedna dávka obsahuje po rekonstituci 25/50/75/100 mikrogramů hormonum parathyroidum (rDNA)* v 71,4 mikrolitrech roztoku. Jedna zásobní vložka obsahuje 350/700/1050/1400 mikrogramů hormonum parathyroidum (rDNA). *Parathormon (rDNA) produkovaný E. coli pomocí rekombinantní DNA technologie je identický se sekvencí 84 aminokyselin endogenního lidského parathormonu. Indikace: Přípravek Natpar je indikován jako přídatná léčba dospělých pacientů s chronickou hypoparathyreózou, kteří nejsou dostatečně kontrolováni samostatnou standardní léčbou. Dávkování a způsob podání: Zahajte léčbu 50 mikrogramy jednou denně subkutánní injekcí do stehna (střídejte stehna každý den). Pokud je před podáním dávky sérové kalcium > 2,25 mmol/l, je možné zvážit podání počáteční dávky 25 mikrogramů. U pacientů užívajících aktivní vitamin D snižte jeho dávku o 50 %, pokud je sérové kalcium před podáním dávky nad 1,87 mmol/l. Udržujte doplňkovou dávku kalcia. Změřte sérovou koncentraci kalcia během 2 až 5 dnů před podáním dávky. Pokud je sérová hladina kalcia před dávkou pod 1,87 mmol/l nebo nad 2,55 mmol/l, mělo by se měření opakovat následující den. Upravte dávku aktivního vitamínu D nebo doplňku kalcia nebo obou na základě sérové hladiny kalcia a klinického hodnocení. Úpravy se mají opakovat, dokud nebudou cílové hladiny sérového kalcia před dávkou v rozsahu 2,0 – 2,25 mmol/l, aktivní vitamín D bude ukončen a doplněk kalcia je dostatečný pro splnění denních požadavků. Během titrace musí být monitorována koncentrace sérového kalcia. Dávka přípravku Natpar se může zvýšit o 25 mikrogramů přibližně každé 2 až 4 týdny, do maximální denní dávky 100 mikrogramů. K titraci dávky dolů na minimum 25 mikrogramů může dojít kdykoliv. Pokyny k úpravě dávky po úvodním období – viz SPC. Přípravek Natpar je vhodný pro podávání samotným pacientem jako subkutánní injekce jednou denně střídavě do každého stehna. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. U pacientů, kteří podstupují nebo dříve podstupovali radioterapii skeletu, s malignitami skeletu nebo kostními metastázami, kteří mají zvýšené výchozí riziko vzniku osteosarkomu (pacienti s Pagetovou chorobou kostí nebo dědičnými poruchami), s nevysvětleným zvýšením kostní alkalické fosfatázy a s pseudohypoparathyreózou. Zvláštní upozornění a opatření pro použití: Monitorování pacientů během léčby: Sérové hladiny kalcia před dávkou a v některých případech po dávce musí být během léčby přípravkem Natpar sledovány. Hyperkalcemie: často se objevovala během titračního období. V případě závažné hyperkalcemie (> 3,0 mmol/l nebo nad horní hranici normy s příznaky), zvažte hydrataci a dočasné zastavení podávání přípravku Natpar, kalcia a aktivního vitamínu D, dokud se sérové kalcium nevrátí do normálního rozsahu. Hypokalcemie: Riziko závažné hypokalcemie je nejvyšší po odložení podání, vynechání nebo náhlém vysazení přípravku Natpar, může se ale vyskytnout kdykoli. Souběžné použití se srdečními glykosidy: Hyperkalcemie z jakékoliv příčiny může predisponovat k toxicitě digitalis. Závažná porucha funkce ledvin nebo jater: Používat s opatrností u pacientů se závažnou poruchou ledvin nebo jater. Použití u mladých dospělých: Používat s opatrností u mladých dospělých pacientů s otevřenými epifýzami, protože tito pacienti mohou být vystaveni zvýšenému riziku vzniku osteosarkomu. Použití u starších pacientů: Klinické studie nezahrnovaly dostatečný počet subjektů ve věku ≥ 65 let pro stanovení, zda je odpověď u těchto subjektů odlišná od mladších subjektů. Tachyfylaxe: Účinek přípravku Natpar se může po čase u některých pacientů snížit. Urolitiáza: U pacientů s aktivní nebo nedávnou urolitiázou je nutno používat přípravek Natpar s opatrností vzhledem k jeho potenciálu tento stav zhoršovat. Hypersenzitivita: Po uvedení na trh byly hlášeny hypersenzitivní reakce, které mohou zahrnovat anafylaxi, dyspnoi, angioedém, kopřivku, vyrážku atd. Interakce: Kombinované použití přípravku Natpar a srdečních glykosidů může pacienty predisponovat k toxicitě digitalisu, pokud vznikne hyperkalcémie. Současné používání přípravku Natpar s bisfosfonáty se nedoporučuje. Fertilita, těhotenství a kojení: Údaje o podávání přípravku Natpar těhotným ženám nejsou k dispozici. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky. Není známo, zda se přípravek Natpar vylučuje do lidského mateřského mléka. Dostupné farmakologické údaje u zvířat prokázaly vylučování přípravku Natpar do mléka. Neexistují žádné údaje u člověka o vlivu přípravku Natpar na plodnost. Studie na zvířatech nenaznačují žádnou poruchu plodnosti. Nežádoucí účinky: Nejčastější nežádoucí reakce byly hyperkalcemie, hypokalcemie a jejich související klinické projevy, zahrnující bolesti hlavy, průjem, zvracení, parestezie, hypestezie a hyperkalciurie. Ostatní nežádoucí účinky – viz SPC. Předávkování: Může způsobit hyperkalcémii. Těžká hyperkalcémie může být život ohrožující stav vyžadující neodkladnou lékařskou péči a pečlivé monitorování. Podmínky uchovávání: Uchovávejte v chladničce (2 °C – 8 °C). Chraňte před mrazem. Uchovávejte zásobní vložky v držáku v krabičce, aby byly chráněny před světlem. Podmínky uchovávání po rekonstituci – viz SPC. Držitel rozhodnutí o registraci: Shire Pharmaceuticals Ireland Limited, Block 2 & 3 Miesian Plaza, 50 – 58 Baggot Street Lower, Dublin 2, Irsko. Registrační čísla: EU/1/15/1078/001-004. Poslední revize SPC: 04/2020.
Výdej léčivého přípravku je vázán na lékařský předpis. Léčivý přípravek není hrazen z prostředků veřejného zdravotního pojištění. Před předepsáním se seznamte s úplným zněním Souhrnu údajů o přípravku.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na SÚKL nebo společnosti Takeda emailem na AE.CZE@takeda.com. Podezření na nežádoucí účinky hlaste také podle národních legislativních požadavků.