VEDOLIZUMAB: BIOLOGIKUM K TERAPII NESPECIFICKÝCH STŘEVNÍCH ZÁNĚTŮ
Idiopatické střevní záněty (IBD) patří mezi onemocnění, která významně ovlivňují zdravotní stav a kvalitu života nemocných. Prognóza pacientů s Crohnovou chorobou a ulcerózní kolitidou se zlepšila se zavedením tzv. biologické léčby. Po téměř dvou dekádách, kdy v tomto smyslu dominovaly monoklonální protilátky proti tumor nekrotizujícímu faktoru alfa, je nyní dostupný také inhibitor integrinu α4β7 vedolizumab, se selektivním účinkem ve střevě a s odlišným mechanismem účinku.
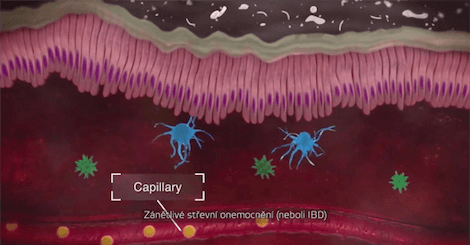
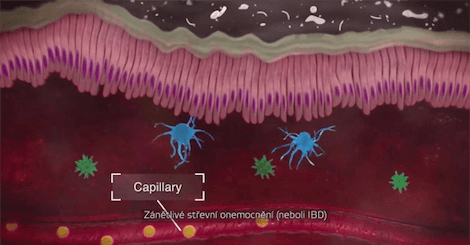
Integrin α4β7 je exprimován na diskrétní podmnožinu paměťových pomocných T-lymfocytů, které preferenčně migrují do gastrointestinálního (GI) traktu a způsobují zánět, jež má charakteristiku ulcerózní kolitidy (UC) a Crohnovy choroby (CD).1
Vedolizumab je imunosupresivní biologický přípravek se selektivním účinkem ve střevě. Je to humanizovaná monoklonální protilátka, která se specificky váže na integrin α4β7. Tím, že se váže k α4β7 exprimovaným na určité lymfocyty, blokuje interakci těchto buněk s mukosální adresinovou buněčnou adhezní molekulou-1 (MAdCAM-1). MAdCAM-1 je především exprimována na střevní endoteliální buňky a hraje kritickou úlohu při homingu T-lymfocytů do tkání v GI traktu. Vedolizumab se neváže na integriny α4β1 a αEβ7 ani neblokuje jejich funkci.1
Vedolizumab u zdravých jedinců, pacientů s UC nebo CD nezvyšuje koncentraci neutrofilů, bazofilů, eosinofilů, B-pomocných a cytotoxických T-lymfocytů, celkový počet paměťových pomocných T-lymfocytů, monocytů nebo NK buněk v periferní krvi bez toho, že by byla pozorována leukocytóza.1
Vedolizumab byl schválen Evropskou lékovou agenturou (EMA) v roce 2014 a indikován je k léčbě dospělých pacientů se středně těžkou až těžkou aktivní CD a UC, u nichž buď nastala neadekvátní odpověď na konvenční terapii, nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují.1
Data o účinnosti ze studie GEMINI I1
Účinnost a bezpečnost vedolizumabu pro léčbu dospělých pacientů se středně těžkou až těžkou aktivní UC (skóre Mayo 6–12 s endoskopickým dílčím skóre ≥ 2) byla prokázána v randomizované, dvojitě zaslepené, placebem kontrolované studii vyhodnocující cílové parametry účinnosti v týdnu 6 a týdnu 52 (GEMINI I), která byla publikovaná v roce 2013. Pacienti zařazení do studie neúspěšně absolvovali nejméně jednu konvenční terapii, a to včetně kortikosteroidů, imunomodulátorů a/nebo infliximabu jako antagonisty TNFα (včetně primárních non-respondérů). Byly povoleny souběžně podávané stabilní dávky perorálních aminosalicylátů, kortikosteroidů a/nebo imunomodulátorů.1
Pro vyhodnocení cílových parametrů v týdnu 6 bylo randomizováno 374 pacientů dvojitě zaslepeným způsobem (3:2), kteří dostali vedolizumab 300 mg nebo placebo v týdnu 0 a týdnu 2. Primárním cílovým parametrem byl podíl nemocných s klinickou odpovědí (definovaná jako snížení úplného skóre Mayo o ≥ 3 body a ≥ 30 % vůči výchozímu stavu s doprovodným snížením dílčího skóre rektálního krvácení o ≥1 bod nebo s absolutní hodnotou dílčího skóre rektálního krvácení ≤ 1 bod) v týdnu 6. Příznivý účinek vedolizumabu na klinickou odezvu, remisi a hojení sliznic byl pozorován jak u pacientů bez předchozí expozice antagonistům TNFα, tak i u nemocných, kteří byli v předchozí léčbě antagonisty TNFα neúspěšní.1
V rámci indukční fáze dosáhlo statisticky velmi významné klinické odpovědi více nemocných ve skupině s účinnou látkou (47 % vs. 26 %; p < 0,0001), stejně jako klinické remise (17 % vs. 5 %; p ≤ 0,001). Zahojení sliznice bylo statisticky významně pozorováno u 41 % pacientů na vedolizumabu a jen u čtvrtiny z těch, kteří dostávali placebo (p < 0,05).1
V GEMINI I užívaly vedolizumab dvě kohorty pacientů v týdnech 0 a 2: v 1. kohortě byli randomizováni dvojitě zaslepeně tak, aby užívali vedolizumab 300 mg nebo placebo, a ve 2. kohortě byli léčeni v otevřené studii vedolizumabem 300 mg. Na počátku týdne 6 byli pacienti, kteří dosáhli klinické odpovědi a užívali kortikosteroidy, požádáni, aby přešli na režim snižování dávky kortikosteroidů. Primárním cílovým parametrem byl podíl nemocných v klinické remisi v týdnu 52.1
Na indukční fázi studie GEMINI I navázala fáze udržovací. Zapojeni do ní byli nemocní, kteří vykázali odpověď na vedolizumab v 6. týdnu úvodní terapie. Ti byli následně v dvojitém zaslepení (1:1:1) do jednoho z následujících režimů počínaje týdnem 6: buď k 300 mg vedolizumabu 1× za 4 týdny, ke stejné dávce 1× za 8 týdnů, anebo k placebu, po celkovou dobu 1 roku. Opět se statisticky velmi významně potvrdilo, že ti, kdo užívali vedolizumab, dosáhli častěji klinické remise (45 % resp. 42 %, vs. 16 %; p < 0,0001), statisticky velmi významně častější bylo také zhojení sliznice (56 % resp. 52 %, vs. 20 %; p < 0,0001).
Příznivý bezpečnostní profil2
Vedolizumab funguje na principu selektivní inhibice lymfocytární infiltrace střevní stěny. Jeho střevní selektivita je důležitá – podobně totiž působí také inhibitor integrinu α4 natalizumab, který, kromě integrinu α4β7, blokuje také integrin α4β1 v centrálním nervovém systému. Jeho podávání je ale omezeno zvýšeným rizikem progresivní multifokální leukoencefalopatie (PML), fatálního demyelinizačního onemocnění způsobeného JC virem.2
Bezpečnostní data, týkající se vedolizumabu, byla shrnuta v článku, publikovaném v časopise Gut. Tato práce integrovala poznatky ze 6 různých klinických studií (placebem kontrolované C13002 a GEMINI I, II a III; open-label C13004 a GEMINI LTS) provedených v letech 2009–2013.2
Zahrnula informace o 2830 nemocných, kteří byli vystaveni dohromady 4811 paciento- rokům užívání vedolizumabu. Během sledovaného období nebyla popsána asociace mezi aplikací vedolizumabu a zvýšeným rizikem infekce. Závažné případy klostridiové kolitidy, sepse či tuberkulózy se v souboru vyskytly pouze vzácně (≤ 0,6 % pacientů) a nebyl zaznamenán žádný případ PML.2
Při podávání vedolizumabu se jako statisticky velmi významný nezávislý rizikový faktor pro rozvoj závažné infekce u nemocných s UC ukázalo předchozí selhání anti-TNFα medikace (HR, 1,99; 95% CI 1,16 –3,42; p = 0,0122) a užívání opiátových analgetik (HR, 2,68; 95% CI 1,57– 4,58; p = 0,0003), u pacientů s CD to byl opět statisticky velmi významně mladší věk (HR 0,97; 95% CI 0,95–0,98; p < 0,0001), užívání opiátů (HR, 2,72; 95% CI 1,90 – 3,89; p < 0,0001) nebo kortikosteroidů (HR, 1,88; 95% CI 1,35–2,63; p = 0,0002). Rovněž reakce na infuzní podání vedolizumabu byly relativně vzácné, v žádné ze zahrnutých studií nebyly častější než u 5 % nemocných. Malignita byla diagnostikována u celkem 18 osob z celého souboru, tedy u méně než jednoho procenta.2
Vedolizumab vykazuje příznivý bezpečnostní profil s nízkým výskytem závažných infekcí, infuzních reakcí (≤ 5 %) a malignit, a to i v rámci prodlouženého podávání.2
Reference:
1. Souhrn údajů o přípravku (SPC Entyvio 300 mg).
2. Colombel J-F, et al. Gut 2017;66:839-851
CZ/VED/1604/0011a
MUDr. Přemysl Falt, Ph.D. z Fakultní nemocnice Olomouc se v krátkém interview vyjádřil k tématice head to head studií, jejich přínosu pro běžnou praxia podrobněji se věnoval výsledkům studie VARSITY
MUDr. Přemysl Falt, Ph.D. z Fakultní nemocnice Olomouc se v krátkém interview vyjádřil k tématice head to head studií,
UEGW 2018 – SLIZNIČNÍ HOJENÍ U CROHNOVY NEMOCI (TAKEDA SYMPOZIUM) – PETER IRVING, MA, MD, FRCP
UEGW 2018 – SLIZNIČNÍ HOJENÍ U CROHNOVY NEMOCI (TAKEDA SYMPOZIUM) – PETER IRVING, MA, MD, FRCP
MECHANISMUS ONEMOCNĚNÍ IBD
MECHANISMUS ONEMOCNĚNÍ IBD CZ/VED/1807/0026
ENTYVIO MECHANISMUS ÚČINKU
ENTYVIO MECHANISMUS ÚČINKU CZ/VED/1605/0013a
Co zaujalo Vaše kolegy na prvním ročníku IBD FÓRA 2019?
CO ZAUJALO VAŠE KOLEGY NA PRVNÍM ROČNÍKU IBD FÓRA 2019? V polovině června proběhl první ročník mezioborového sympozia, zaměřeného na léčbu IBD
STUDIE VARSITY – PRVNÍ HEAD-TO-HEAD SROVNÁNÍ BIOLOGIK U ULCERÓZNÍ KOLITIDY
STUDIE VARSITY – PRVNÍ HEAD-TO-HEAD SROVNÁNÍ BIOLOGIK U ULCERÓZNÍ KOLITIDY Přímá head-to-head porovnání účinných látek i nadále zůstávají v klinickém
ÚDAJE O ÚČINNOSTI VEDOLIZUMABU ZE STUDIE VERSIFY
ÚDAJE O ÚČINNOSTI VEDOLIZUMABU ZE STUDIE VERSIFY1 Studie VERSIFY je prospektivní, multicentrická, otevřená klinická studie fáze 3B, ve které
VEDOLIZUMAB POTVRZUJE SVOU ÚČINNOST Z KLINICKÝCH STUDIÍ I V KLINICKÉ PRAXI
VEDOLIZUMAB POTVRZUJE SVOU ÚČINNOST Z KLINICKÝCH STUDIÍ I V KLINICKÉ PRAXI Počátkem září proběhlo oficiální uvedení vedolizumabu (VDZ), biologického
ENTYVIO
Zkrácené informace o přípravku
Název: Entyvio 300 mg prášek pro koncentrát pro infuzní roztok. Složení: Jedna injekční lahvička obsahuje vedolizumabum 300 mg. Po rekonstituci jeden ml obsahuje vedolizumabum 60 mg. Seznam pomocných látek viz SPC. Indikace: Léčba dospělých pacientů se středně těžkou až těžkou aktivní ulcerózní kolitidou nebo se středně těžkou až těžkou aktivní Crohnovou chorobou, u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují. Dávkování a způsob podání: Doporučená dávka je 300 mg podávaných i.v. infuzí v týdnu nula, dva a šest a dále pak každých osm týdnů. Ulcerózní kolitida: Pokud se neprokáže léčebný přínos do týdne 10, je zapotřebí léčbu ukončit. Crohnova choroba:Pacienti, u nichž nedošlo k odpovědi na léčbu, mohou mít prospěch z dávky v týdnu 10. U pacientů, kteří na léčbu reagují, se má v léčbě pokračovat od týdne 14 každých osm týdnů. Pokud se neprokáže léčebný přínos do týdne 14, léčba pacientů s Crohnovou chorobou se má ukončit. Při poklesu odpovědi mohou mít někteří pacienti prospěch ze zvýšení frekvence podávání přípravku Entyvio 300 mg na každé čtyři týdny. Pokud bude léčba přerušena a bude zapotřebí léčbu obnovit, je možné zvážit podávání každé čtyři týdny. Bezpečnost a účinnost vedolizumabu u dětí ve věku od 0 do 17 let nebyla dosud stanovena. U starších pacientů se úprava dávkování nevyžaduje. Přípravek je určen pouze k intravenóznímu podání jako intravenózní infuze po dobu 30 minut. Před podáním je zapotřebí jej rekonstituovat a dále naředit (viz SPC). Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Aktivní závažné infekce, jako jsou tuberkulóza, sepse, cytomegalovirus, listerióza, a oportunní infekce, jako je progresivní multifokální leukoencefalopatie (PML). Zvláštní upozornění: Všechny pacienty je třeba nepřetržitě sledovat během každé infuze a dále přibližně jednu hodinu (u prvních dvou infuzí dvě hodiny) po ukončení infuze. Byly hlášeny reakce související s infuzí (IRR) a hypersenzitivní reakce. Existuje potenciální zvýšené riziko oportunních infekcí nebo infekcí, pro něž je střevo ochrannou bariérou. Před zahájením léčby musí být pacienti vyšetřeni na tuberkulózu. Pokud vznikne podezření na PML, léčba se musí přerušit; pokud se potvrdí, léčba se musí trvale zastavit. Souběžné používání přípravku s biologickými imunosupresivy se nedoporučuje. Při léčbě se může pokračovat v očkování neživými vakcínami. Očkování vakcínou proti chřipce se má provádět injekčním podáním ve shodě s rutinní klinickou praxí. Ostatní živé vakcíny lze podávat pouze v případě, že přínosy jasně převažují nad riziky. Vedolizumab podávaný pacientům bez souběžné léčby kortikosteroidy může být méně účinný v indukci remise Crohnovy choroby než při souběžné lěčbě kortikosteroidy. Lékovéinterakce: Společné podávání kortikosteroidů, imunomodulátorů a aminosalicylátů nemá klinicky významný účinek na farmakokinetiku vedolizumabu. Živé vakcíny, zejména perorální živé vakcíny, je nutno s přípravkem Entyvio používat s opatrností. Těhotenství a kojení: Ženy, které mohou otěhotnět, mají používat adekvátní antikoncepci a pokračovat v jejím užívání nejméně 18 týdnů od poslední léčby. Podávání přípravku Entyvio v těhotenství se z preventivních důvodů nedoporučuje, pokud přínos jeho podávání jasně nepřeváží nad potenciálním rizikem pro matku i plod. Vedolizumab byl zjištěn v mateřském mléce. Při použití vedolizumabu u kojících žen je třeba vzít v úvahu přínos léčby pro matku a potenciální rizika pro kojence. Účinky na schopnost řídit a obsluhovat stroje: Přípravek Entyvio má malý vliv na schopnost řídit nebo obsluhovat stroje, protože u malého počtu pacientů byly hlášeny závratě. Nežádoucí účinky: Nejčastěji hlášenými nežádoucími účinky jsou infekce (jako jsou nazsofaryngitida, infekce horních cest dýchacích, bronchitida, chřipka a sinusitida), bolest hlavy, nauzea, pyrexie, únava, kašel, artralgie. Byly také hlášeny reakce v místě injekce. Ostatní viz SPC. Ve studiích byly hlášeny závažné infekce, které zahrnují tuberkulózu, sepse (některé fatální), salmonelovou sepsi, listeriovou meningitidu a cytomegalovirovou kolitidu. Během léčby vedolizumabem se mohou vytvořit protilátky proti vedolizumabu, z nichž většina je neutralizujících. Reakce související s infuzí jsou hlášeny po infuzi vedolizumabu u pacientů s protilátkami proti vedolizumabu. Doba použitelnosti: 3 roky. Stabilita po otevření před použitím rekonstituovaného roztoku v injekční lahvičce byla prokázána po dobu 8 hodin při teplotě 2 °C – 8 °C. Kombinovaná stabilita po otevření před použitím přípravku Entyvio v injekční lahvičce a infuzního vaku s injekčním roztokem chloridu sodného 9mg/ml (0,9%) činí celkem 12 hodin při teplotě 20 °C – 25 °C nebo 24 hodin při teplotě 2 °C – 8 °C. Chraňte rekonstituovaný roztok v injekční lahvičce nebo naředěný roztok v infuzním vaku před mrazem. Zvláštní požadavky na podmínky uchovávání: Injekční lahvičku uchovávejte v chladničce (2 °C- 8 °C) v krabičce, aby byl přípravek chráněn před světlem. Držitel rozhodnutí o registraci: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko. Registrační číslo: EU/1/14/923/001. Datum poslední revize: 20. 2. 2019
Přípravek je hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Před předepsáním se seznamte s úplným zněním Souhrnu údajů o přípravku.
Název: Entyvio 300 mg prášek pro koncentrát pro infuzní roztok. Složení: Jedna injekční lahvička obsahuje vedolizumabum 300 mg. Po rekonstituci jeden ml obsahuje vedolizumabum 60 mg. Seznam pomocných látek viz SPC. Indikace: Léčba dospělých pacientů se středně těžkou až těžkou aktivní ulcerózní kolitidou nebo se středně těžkou až těžkou aktivní Crohnovou chorobou, u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují. Dávkování a způsob podání: Doporučená dávka je 300 mg podávaných i.v. infuzí v týdnu nula, dva a šest a dále pak každých osm týdnů. Ulcerózní kolitida: Pokud se neprokáže léčebný přínos do týdne 10, je zapotřebí léčbu ukončit. Crohnova choroba:Pacienti, u nichž nedošlo k odpovědi na léčbu, mohou mít prospěch z dávky v týdnu 10. U pacientů, kteří na léčbu reagují, se má v léčbě pokračovat od týdne 14 každých osm týdnů. Pokud se neprokáže léčebný přínos do týdne 14, léčba pacientů s Crohnovou chorobou se má ukončit. Při poklesu odpovědi mohou mít někteří pacienti prospěch ze zvýšení frekvence podávání přípravku Entyvio 300 mg na každé čtyři týdny. Pokud bude léčba přerušena a bude zapotřebí léčbu obnovit, je možné zvážit podávání každé čtyři týdny. Bezpečnost a účinnost vedolizumabu u dětí ve věku od 0 do 17 let nebyla dosud stanovena. U starších pacientů se úprava dávkování nevyžaduje. Přípravek je určen pouze k intravenóznímu podání jako intravenózní infuze po dobu 30 minut. Před podáním je zapotřebí jej rekonstituovat a dále naředit (viz SPC). Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Aktivní závažné infekce, jako jsou tuberkulóza, sepse, cytomegalovirus, listerióza, a oportunní infekce, jako je progresivní multifokální leukoencefalopatie (PML). Zvláštní upozornění: Všechny pacienty je třeba nepřetržitě sledovat během každé infuze a dále přibližně jednu hodinu (u prvních dvou infuzí dvě hodiny) po ukončení infuze. Byly hlášeny reakce související s infuzí (IRR) a hypersenzitivní reakce. Existuje potenciální zvýšené riziko oportunních infekcí nebo infekcí, pro něž je střevo ochrannou bariérou. Před zahájením léčby musí být pacienti vyšetřeni na tuberkulózu. Pokud vznikne podezření na PML, léčba se musí přerušit; pokud se potvrdí, léčba se musí trvale zastavit. Souběžné používání přípravku s biologickými imunosupresivy se nedoporučuje. Při léčbě se může pokračovat v očkování neživými vakcínami. Očkování vakcínou proti chřipce se má provádět injekčním podáním ve shodě s rutinní klinickou praxí. Ostatní živé vakcíny lze podávat pouze v případě, že přínosy jasně převažují nad riziky. Vedolizumab podávaný pacientům bez souběžné léčby kortikosteroidy může být méně účinný v indukci remise Crohnovy choroby než při souběžné lěčbě kortikosteroidy. Lékovéinterakce: Společné podávání kortikosteroidů, imunomodulátorů a aminosalicylátů nemá klinicky významný účinek na farmakokinetiku vedolizumabu. Živé vakcíny, zejména perorální živé vakcíny, je nutno s přípravkem Entyvio používat s opatrností. Těhotenství a kojení: Ženy, které mohou otěhotnět, mají používat adekvátní antikoncepci a pokračovat v jejím užívání nejméně 18 týdnů od poslední léčby. Podávání přípravku Entyvio v těhotenství se z preventivních důvodů nedoporučuje, pokud přínos jeho podávání jasně nepřeváží nad potenciálním rizikem pro matku i plod. Vedolizumab byl zjištěn v mateřském mléce. Při použití vedolizumabu u kojících žen je třeba vzít v úvahu přínos léčby pro matku a potenciální rizika pro kojence. Účinky na schopnost řídit a obsluhovat stroje: Přípravek Entyvio má malý vliv na schopnost řídit nebo obsluhovat stroje, protože u malého počtu pacientů byly hlášeny závratě. Nežádoucí účinky: Nejčastěji hlášenými nežádoucími účinky jsou infekce (jako jsou nazsofaryngitida, infekce horních cest dýchacích, bronchitida, chřipka a sinusitida), bolest hlavy, nauzea, pyrexie, únava, kašel, artralgie. Byly také hlášeny reakce v místě injekce. Ostatní viz SPC. Ve studiích byly hlášeny závažné infekce, které zahrnují tuberkulózu, sepse (některé fatální), salmonelovou sepsi, listeriovou meningitidu a cytomegalovirovou kolitidu. Během léčby vedolizumabem se mohou vytvořit protilátky proti vedolizumabu, z nichž většina je neutralizujících. Reakce související s infuzí jsou hlášeny po infuzi vedolizumabu u pacientů s protilátkami proti vedolizumabu. Doba použitelnosti: 3 roky. Stabilita po otevření před použitím rekonstituovaného roztoku v injekční lahvičce byla prokázána po dobu 8 hodin při teplotě 2 °C – 8 °C. Kombinovaná stabilita po otevření před použitím přípravku Entyvio v injekční lahvičce a infuzního vaku s injekčním roztokem chloridu sodného 9mg/ml (0,9%) činí celkem 12 hodin při teplotě 20 °C – 25 °C nebo 24 hodin při teplotě 2 °C – 8 °C. Chraňte rekonstituovaný roztok v injekční lahvičce nebo naředěný roztok v infuzním vaku před mrazem. Zvláštní požadavky na podmínky uchovávání: Injekční lahvičku uchovávejte v chladničce (2 °C- 8 °C) v krabičce, aby byl přípravek chráněn před světlem. Držitel rozhodnutí o registraci: Takeda Pharma A/S, Dybendal Alle 10, 2630 Taastrup, Dánsko. Registrační číslo: EU/1/14/923/001. Datum poslední revize: 20. 2. 2019
Přípravek je hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Před předepsáním se seznamte s úplným zněním Souhrnu údajů o přípravku.