ID 360 2022 – přednáška MUDr. Alexandry Jungové, Ph.D.: Sekundární imunodeficience u hematoonkologických pacientů
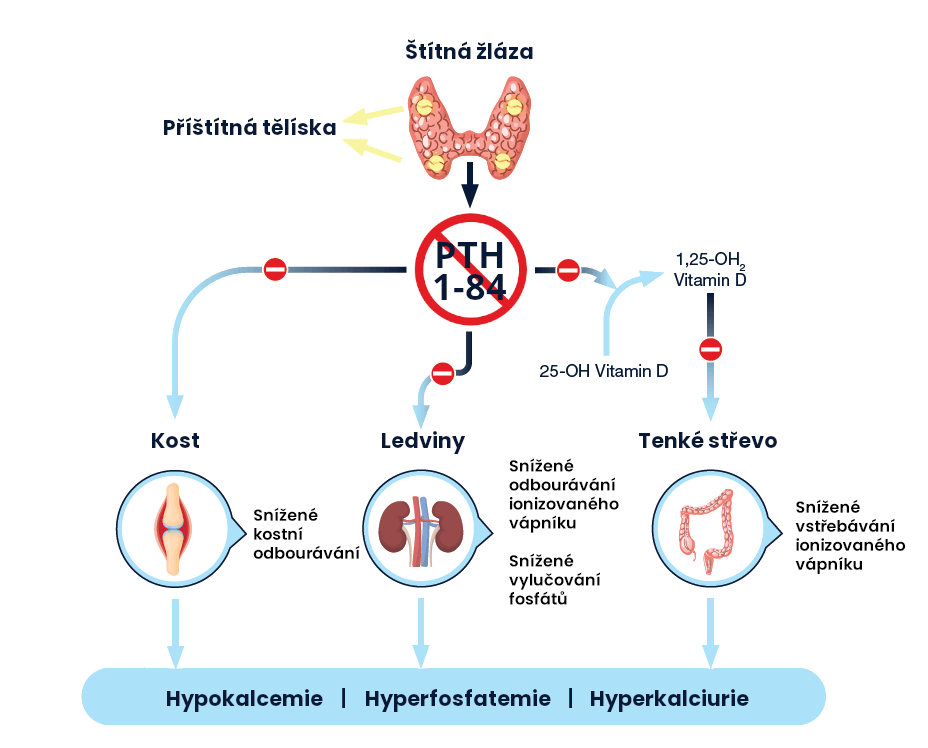
Endogenní parathormon (PTH) je vylučován příštítnými tělísky jako polypeptid z 84 aminokyselin. PTH působí prostřednictvím buněčných povrchových receptorů na parathormon, které jsou přítomné v kosti, ledvinách a nervové tkáni.
Parathormon má celou řadu zásadních fyziologických funkcí, které zahrnují jeho ústřední úlohu při regulaci hladiny kalcia a fosfátů v séru v pevně daných hladinách, regulaci vylučování kalcia a fosfátu ledvinami, aktivaci vitaminu D a udržování normálního kostního obratu.
Natpar je produkovaný E. coli pomocí rekombinantní DNA technologie a je identický s 84 aminokyselinovou sekvencí endogenního lidského parathormonu. Natpar má stejnou primární aminokyselinovou sekvenci jako endogenní parathormon a je možné předpokládat, že má stejné fyziologické účinky.
PTH (1-84) je hlavním regulátorem homeostázy kalcia v plazmě. V ledvinách zvyšuje PTH (1-84) renální tubulární reabsorpci kalcia a podporuje vylučování fosfátů. Celkový účinek PTH je zvýšení koncentrace kalcia v séru, snížení vylučování kalcia močí a nižší koncentrace fosfátů v séru.
DEFINICE PACIENTA S CHRONICKOU
HYPOPARATYREÓZOU,
který není dostatečně kontrolován samostatnou standardní léčbou a u kterého by měla být zvážena substituční léčba rhPTH (1–84).1,3
Dosažení jednoho či více následujících kritérií Vám může pomoci
identikovat nedostatečně kontrolovaného pacienta.1-4
SLEDOVANÁ KRITÉRIA
Současná léčba1-4
Denní perorální dávka převyšuje:
· 2,5 g kalcia NEBO · 1,5 µg kalcitriolu nebo 3 µg alfakalcidolu
Biochemické parametry1-4
· Nemožnost udržet optimální hladinu sérového kalcia v dolním pásmu referenčního rozmezí
případně mírně pod dolní referenční mez, bez dokumentovaných epizod hyperkalcemie
· Opakující se hyperkalciurie > 7,5 mmol/24 h u mužů a > 6,25 mmol/24 h u žen
· Snížení glomerulární filtrace (GF) < 1,0 ml/s/1,73 m² (< 60 ml/min/1,73 m²)
· Hyperfosfatemie A/NEBO kalcio-fosfátový produkt > 4,4 mmol2/l2
Život ohrožující symptomy spojené s hypoparatyreózou1
· Broncho/laryngospasmus · Arytmie · Generalizované křeče
Jiné parametry1-4
· Komorbidity jako je nefrolitiáza nebo o nefrokalcinóza dle zobrazovacích metod
· Prokazatelná klinicky závažná malabsorpce GIT
Výrazně omezená kvalita života z důvodu přítomnosti závažných symptomů hypokalcemie1-4
Před zahájením léčby přípravkem Natpar
- Natpar je vhodný pro podávání samotným pacientem. Každá dávka se musí podávat jako subkutánní injekce
jednou denně, střídavě do každého stehna.1 - Pacienti musí být proškoleni předepisujícím lékařem nebo zdravotnickým odborným personálem o správném
způsobu aplikace.1
4 různá dávkování – stejná cena
Léčba přípravkem Natpar vyžaduje nastavení a zahájení léčby,
úpravu dávky a sledování
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku.
NASTAVENÍ A ZAHÁJENÍ LÉČBY PŘÍPRAVKEM NATPAR1
PŘED zahájením léčby
- Ujistěte se o dostatečném stavu zásobení 25-OH vitaminem D
- Ověřte, že sérové kalcium a magnesium jsou v referenčním rozmezí
- Dle hodnoty sérového kalcia se rozhodněte o počáteční dávce přípravku Natpar a aktivního vitaminu D
ZAHÁJENÍ léčby
Počáteční dávka přípravku Natpar: léčba se zahajuje dávkou 50 µg jednou denně subkutánní injekcí do jednoho ze stehen. Pokud je před podáním dávky sérové kalcium >2,25 mmol/l, je možné zvážit podání počáteční dávky 25 μg.
Cíl léčby:
- hladina sérového kalcia před dávkou je v rozmezí 2,0–2,25 mmol/l
- snížení nebo přerušení suplementace aktivním vitaminem D
- dostatečná suplementace kalcia
Měření požadované před zahájením léčby přípravkem Natpar
- Aktivní vitamin D: Pokud je sérové kalcium před podáním dávky > 1,87 mmol/l a pacient užívá aktivní vitamin D,
snižte jeho dávku o 50 %. - Kalcium: U pacientů, kteří užívají doplňky kalcia, udržujte jejich dávku.
ÚPRAVA DÁVKY PŘÍPRAVKU NATPAR V PRŮBĚHU LÉČBY1
I. Úprava dávky PO zahájení léčby
Kontrolní odběry v rozmezí 2–5 dnů po první aplikaci přípravku Natpar
- Změřte sérové kalcium před podáním pravidelné dávky (24 hodin po poslední aplikaci), a pokud je hladina
sérového kalcia < 1,87 mmol/l nebo > 2,55 mmol/l zopakujte měření následující den. - Upravte dávku aktivního vitaminu D nebo doplňku kalcia (nebo obou) na základě sérové hladiny kalcia a Vašeho
klinického hodnocení (tzn. příznaky hypokalcemie nebo hyperkalcemie).
II. Úprava dávky V PRŮBĚHU léčby (titrace)
Kontrolní odběry po 14–28 dnech od první aplikace přípravku Natpar
Dávka přípravku Natpar se může zvýšit o 25 µg každé 2–4 týdny, do dosažení maximální denní dávky 100 µg.
Snížení dávky na minimálních 25 µg může proběhnout kdykoli.
Pro optimalizaci léčby se doporučuje změřit hladinu sérového kalcia korigovanou na albumin 8–12 hodin po podání
přípravku Natpar (maximální hodnota). Před plánovaným zvýšením dávky přípravku Natpar je doporučeno opakované
měření hladiny sérového kalcia korigovaného na albumin před a po aplikaci přípravku Natpar.
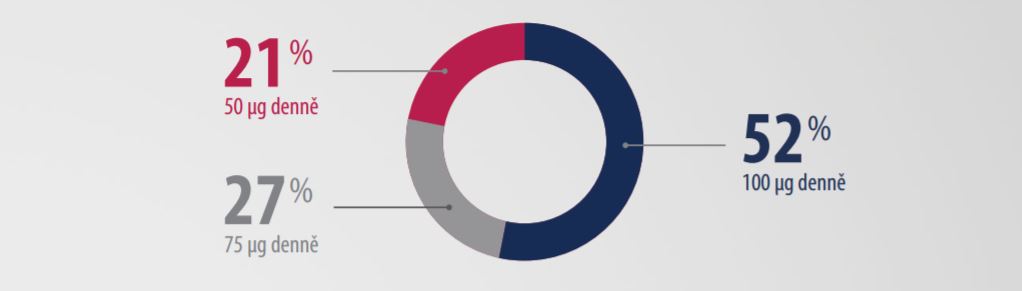
Data z klinických studií ukazují, že u více jak poloviny pacientů léčených přípravkem Natpar je dávka upravena na maximální možnou dávku 100 µg denně.5
Natpar podávaný jednou denně zajišťuje stabilní hladinu kalcia po dobu 24 hodin1,6
Dočasné nebo trvalé přerušení léčby přípravkem Natpar musí být doprovázeno monitorováním hladiny kalcia v séru
a zvýšením exogenního kalcia a/nebo podle potřeby zdrojů aktivního vitaminu D.
DLOUHODOBÉ SLEDOVÁNÍ PACIENTA
Doporučené pravidelné sledování:7
U pacientů s chronickou hypoparatyreózou se mohou častěji vyskytnout tyto komorbidity:
Evropská endokrinologická společnost doporučuje individualizovanou léčbu a sledování7
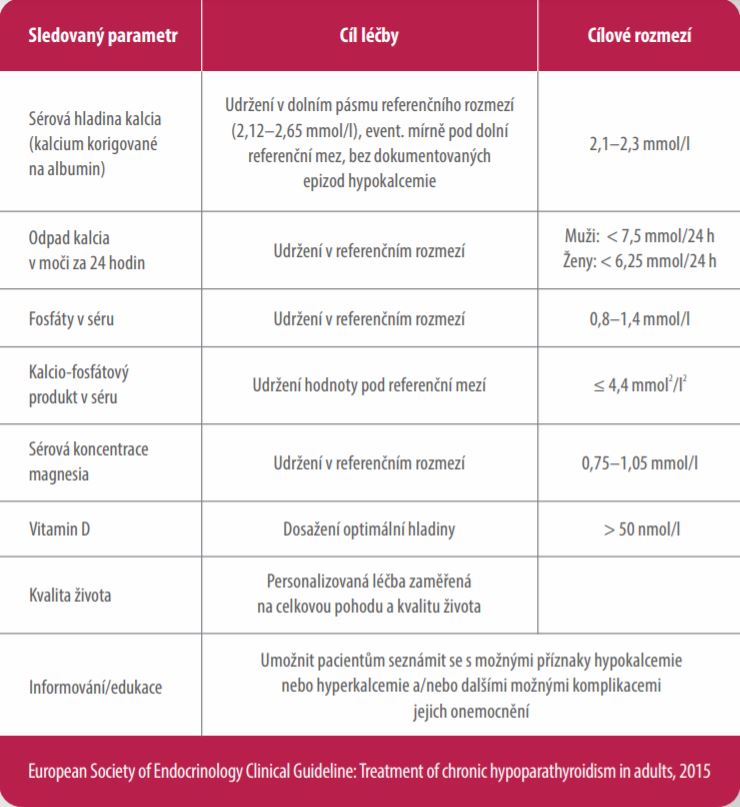
Cílem léčby přípravkem Natpar je dosažení kontroly kalcemie, a tak snížení příznaků hypoparatyreózy společně s optimalizací parametrů kalcio-fosfátového metabolismu1,7
Cíle léčby u pacientů s chronickou hypoparatyreózou7,10
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace
Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT

Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA
programu dle instrukcí
v letáčku. Registraci je nutné
udělat v okamžiku,
kdy bude znám termín prvního
podání LP Natpar u ošetřujícího
endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem pomoci s první
samostatnou aplikací
v domácím prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA programu dle instrukcí v letáčku. Registraci je nutné udělat v okamžiku, kdy bude znám termín prvního podání LP Natpar u ošetřujícího endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace v rámci HYPOPARA programu s cílem pomoci s první samostatnou
aplikací v domácím
prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
Pro zobrazení časové osy otočte vaše mobilní zařízení
Mohlo by Vás zajímat
Endogenní parathormon (PTH) je vylučován příštítnými tělísky jako polypeptid z 84 aminokyselin. PTH působí prostřednictvím buněčných povrchových receptorů na parathormon, které jsou přítomné v kosti, ledvinách a nervové tkáni.
Parathormon má celou řadu zásadních fyziologických funkcí, které zahrnují jeho ústřední úlohu při regulaci hladiny kalcia a fosfátů v séru v pevně daných hladinách, regulaci vylučování kalcia a fosfátu ledvinami, aktivaci vitaminu D a udržování normálního kostního obratu.
Natpar je produkovaný E. coli pomocí rekombinantní DNA technologie a je identický s 84 aminokyselinovou sekvencí endogenního lidského parathormonu. Natpar má stejnou primární aminokyselinovou sekvenci jako endogenní parathormon a je možné předpokládat, že má stejné fyziologické účinky.
PTH (1-84) je hlavním regulátorem homeostázy kalcia v plazmě. V ledvinách zvyšuje PTH (1-84) renální tubulární reabsorpci kalcia a podporuje vylučování fosfátů. Celkový účinek PTH je zvýšení koncentrace kalcia v séru, snížení vylučování kalcia močí a nižší koncentrace fosfátů v séru.
DEFINICE PACIENTA S CHRONICKOU
HYPOPARATYREÓZOU,
který není dostatečně kontrolován samostatnou standardní léčbou a u kterého by měla být zvážena substituční léčba rhPTH (1–84).1,3
Dosažení jednoho či více následujících kritérií Vám může pomoci
identikovat nedostatečně kontrolovaného pacienta.1-4
SLEDOVANÁ KRITÉRIA
Současná léčba1-4
Denní perorální dávka převyšuje:
· 2,5 g kalcia NEBO · 1,5 µg kalcitriolu nebo 3 µg alfakalcidolu
Biochemické parametry1-4
· Nemožnost udržet optimální hladinu sérového kalcia v dolním pásmu referenčního rozmezí
případně mírně pod dolní referenční mez, bez dokumentovaných epizod hyperkalcemie
· Opakující se hyperkalciurie > 7,5 mmol/24 h u mužů a > 6,25 mmol/24 h u žen
· Snížení glomerulární filtrace (GF) < 1,0 ml/s/1,73 m² (< 60 ml/min/1,73 m²)
· Hyperfosfatemie A/NEBO kalcio-fosfátový produkt > 4,4 mmol2/l2
Život ohrožující symptomy spojené s hypoparatyreózou1
· Broncho/laryngospasmus · Arytmie · Generalizované křeče
Jiné parametry1-4
· Komorbidity jako je nefrolitiáza nebo o nefrokalcinóza dle zobrazovacích metod
· Prokazatelná klinicky závažná malabsorpce GIT
Výrazně omezená kvalita života z důvodu přítomnosti závažných symptomů hypokalcemie1-4
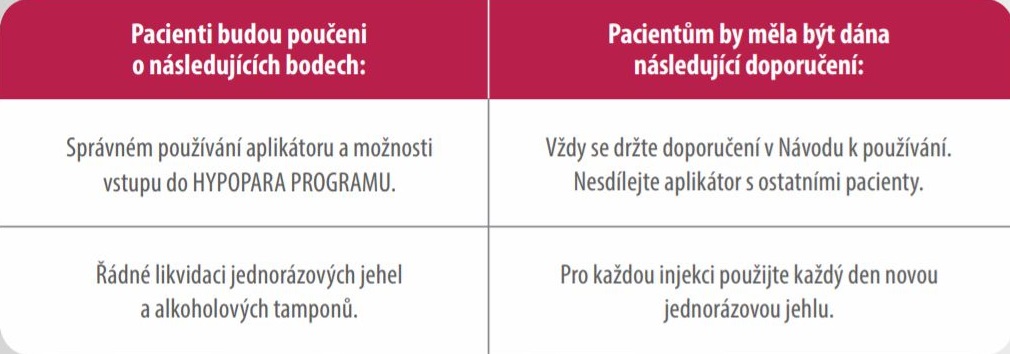
Před zahájením léčby přípravkem Natpar
- Natpar je vhodný pro podávání samotným pacientem. Každá dávka se musí podávat jako subkutánní injekce
jednou denně, střídavě do každého stehna.1 - Pacienti musí být proškoleni předepisujícím lékařem nebo zdravotnickým odborným personálem o správném
způsobu aplikace.1
4 různá dávkování – stejná cena
Léčba přípravkem Natpar vyžaduje nastavení a zahájení léčby,
úpravu dávky a sledování
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku.
NASTAVENÍ A ZAHÁJENÍ LÉČBY PŘÍPRAVKEM NATPAR1
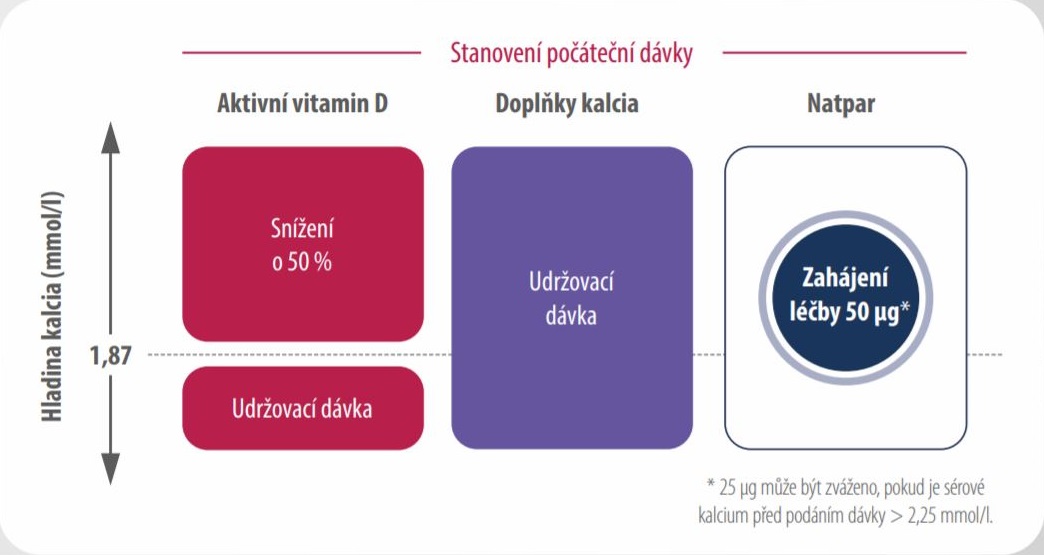
PŘED zahájením léčby
- Ujistěte se o dostatečném stavu zásobení 25-OH vitaminem D
- Ověřte, že sérové kalcium a magnesium jsou v referenčním rozmezí
- Dle hodnoty sérového kalcia se rozhodněte o počáteční dávce přípravku Natpar a aktivního vitaminu D
ZAHÁJENÍ léčby
Počáteční dávka přípravku Natpar: léčba se zahajuje dávkou 50 µg jednou denně subkutánní injekcí do jednoho ze stehen. Pokud je před podáním dávky sérové kalcium >2,25 mmol/l, je možné zvážit podání počáteční dávky 25 μg.
Cíl léčby:
- hladina sérového kalcia před dávkou je v rozmezí 2,0–2,25 mmol/l
- snížení nebo přerušení suplementace aktivním vitaminem D
- dostatečná suplementace kalcia
Měření požadované před zahájením léčby přípravkem Natpar
- Aktivní vitamin D: Pokud je sérové kalcium před podáním dávky > 1,87 mmol/l a pacient užívá aktivní vitamin D,
snižte jeho dávku o 50 %. - Kalcium: U pacientů, kteří užívají doplňky kalcia, udržujte jejich dávku.
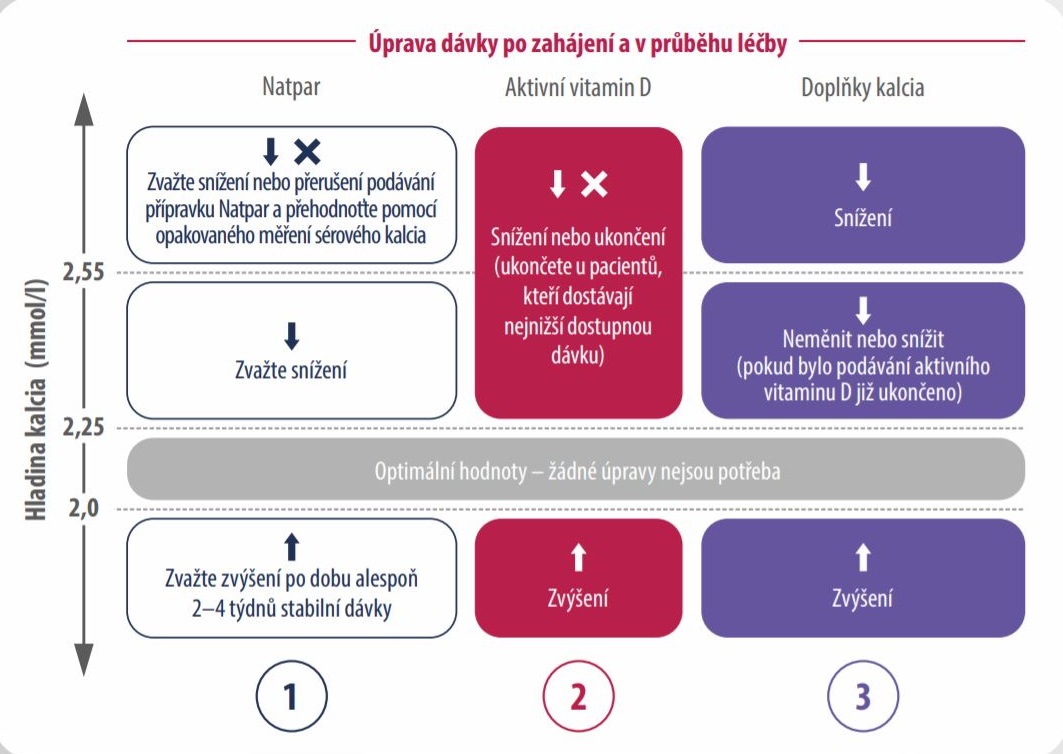
ÚPRAVA DÁVKY PŘÍPRAVKU NATPAR V PRŮBĚHU LÉČBY1
I. Úprava dávky PO zahájení léčby
Kontrolní odběry v rozmezí 2–5 dnů po první aplikaci přípravku Natpar
- Změřte sérové kalcium před podáním pravidelné dávky (24 hodin po poslední aplikaci), a pokud je hladina
sérového kalcia < 1,87 mmol/l nebo > 2,55 mmol/l zopakujte měření následující den. - Upravte dávku aktivního vitaminu D nebo doplňku kalcia (nebo obou) na základě sérové hladiny kalcia a Vašeho
klinického hodnocení (tzn. příznaky hypokalcemie nebo hyperkalcemie).
II. Úprava dávky V PRŮBĚHU léčby (titrace)
Kontrolní odběry po 14–28 dnech od první aplikace přípravku Natpar
Dávka přípravku Natpar se může zvýšit o 25 µg každé 2–4 týdny, do dosažení maximální denní dávky 100 µg.
Snížení dávky na minimálních 25 µg může proběhnout kdykoli.
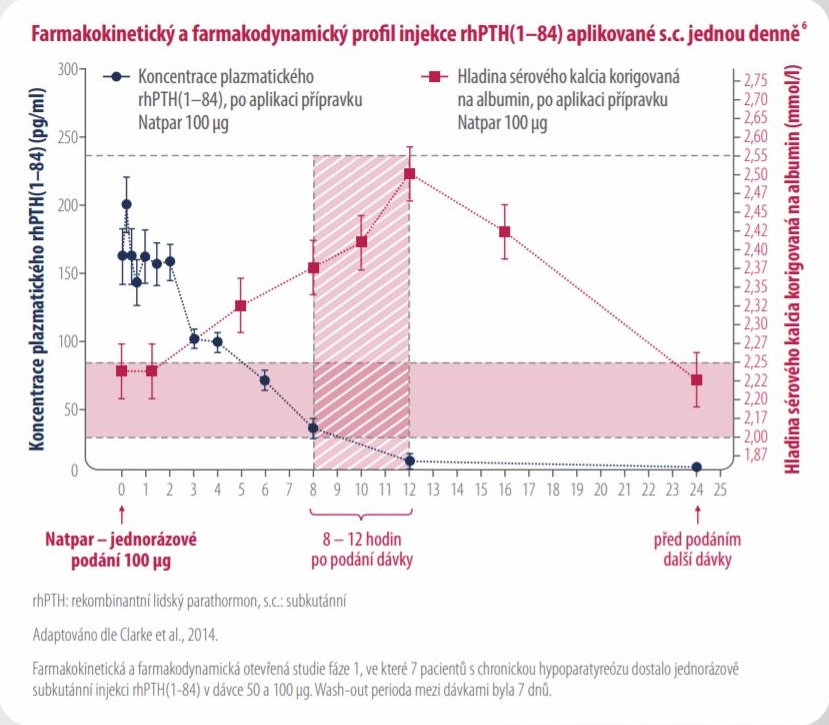
Pro optimalizaci léčby se doporučuje změřit hladinu sérového kalcia korigovanou na albumin 8–12 hodin po podání
přípravku Natpar (maximální hodnota). Před plánovaným zvýšením dávky přípravku Natpar je doporučeno opakované
měření hladiny sérového kalcia korigovaného na albumin před a po aplikaci přípravku Natpar.
Data z klinických studií ukazují, že u více jak poloviny pacientů léčených přípravkem Natpar je dávka upravena na maximální možnou dávku 100 µg denně.5
Natpar podávaný jednou denně zajišťuje stabilní hladinu kalcia po dobu 24 hodin1,6
Dočasné nebo trvalé přerušení léčby přípravkem Natpar musí být doprovázeno monitorováním hladiny kalcia v séru
a zvýšením exogenního kalcia a/nebo podle potřeby zdrojů aktivního vitaminu D.
DLOUHODOBÉ SLEDOVÁNÍ PACIENTA
Doporučené pravidelné sledování:7
U pacientů s chronickou hypoparatyreózou se mohou častěji vyskytnout tyto komorbidity:
Evropská endokrinologická společnost doporučuje individualizovanou léčbu a sledování7
Cílem léčby přípravkem Natpar je dosažení kontroly kalcemie, a tak snížení příznaků hypoparatyreózy společně s optimalizací parametrů kalcio-fosfátového metabolismu1,7
Cíle léčby u pacientů s chronickou hypoparatyreózou7,10
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA
programu dle instrukcí
v letáčku. Registraci je nutné
udělat v okamžiku,
kdy bude znám termín prvního
podání LP Natpar u ošetřujícího
endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem pomoci s první
samostatnou aplikací
v domácím prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA programu dle instrukcí v letáčku. Registraci je nutné udělat v okamžiku, kdy bude znám termín prvního podání LP Natpar u ošetřujícího endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace v rámci HYPOPARA programu s cílem pomoci s první samostatnou
aplikací v domácím
prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
Pro zobrazení časové osy otočte vaše mobilní zařízení
Mohlo by Vás zajímat
Endogenní parathormon (PTH) je vylučován příštítnými tělísky jako polypeptid z 84 aminokyselin. PTH působí prostřednictvím buněčných povrchových receptorů na parathormon, které jsou přítomné v kosti, ledvinách a nervové tkáni.
Parathormon má celou řadu zásadních fyziologických funkcí, které zahrnují jeho ústřední úlohu při regulaci hladiny kalcia a fosfátů v séru v pevně daných hladinách, regulaci vylučování kalcia a fosfátu ledvinami, aktivaci vitaminu D a udržování normálního kostního obratu.
Natpar je produkovaný E. coli pomocí rekombinantní DNA technologie a je identický s 84 aminokyselinovou sekvencí endogenního lidského parathormonu. Natpar má stejnou primární aminokyselinovou sekvenci jako endogenní parathormon a je možné předpokládat, že má stejné fyziologické účinky.
PTH (1-84) je hlavním regulátorem homeostázy kalcia v plazmě. V ledvinách zvyšuje PTH (1-84) renální tubulární reabsorpci kalcia a podporuje vylučování fosfátů. Celkový účinek PTH je zvýšení koncentrace kalcia v séru, snížení vylučování kalcia močí a nižší koncentrace fosfátů v séru.
DEFINICE PACIENTA S CHRONICKOU
HYPOPARATYREÓZOU,
který není dostatečně kontrolován samostatnou standardní léčbou a u kterého by měla být zvážena substituční léčba rhPTH (1–84).1,3
Dosažení jednoho či více následujících kritérií Vám může pomoci
identikovat nedostatečně kontrolovaného pacienta.1-4
SLEDOVANÁ KRITÉRIA
Současná léčba1-4
Denní perorální dávka převyšuje:
· 2,5 g kalcia NEBO · 1,5 µg kalcitriolu nebo 3 µg alfakalcidolu
Biochemické parametry1-4
· Nemožnost udržet optimální hladinu sérového kalcia v dolním pásmu referenčního rozmezí
případně mírně pod dolní referenční mez, bez dokumentovaných epizod hyperkalcemie
· Opakující se hyperkalciurie > 7,5 mmol/24 h u mužů a > 6,25 mmol/24 h u žen
· Snížení glomerulární filtrace (GF) < 1,0 ml/s/1,73 m² (< 60 ml/min/1,73 m²)
· Hyperfosfatemie A/NEBO kalcio-fosfátový produkt > 4,4 mmol2/l2
Život ohrožující symptomy spojené s hypoparatyreózou1
· Broncho/laryngospasmus · Arytmie · Generalizované křeče
Jiné parametry1-4
· Komorbidity jako je nefrolitiáza nebo o nefrokalcinóza dle zobrazovacích metod
· Prokazatelná klinicky závažná malabsorpce GIT
Výrazně omezená kvalita života z důvodu přítomnosti závažných symptomů hypokalcemie1-4
Před zahájením léčby přípravkem Natpar
- Natpar je vhodný pro podávání samotným pacientem. Každá dávka se musí podávat jako subkutánní injekce
jednou denně, střídavě do každého stehna.1 - Pacienti musí být proškoleni předepisujícím lékařem nebo zdravotnickým odborným personálem o správném
způsobu aplikace.1
4 různá dávkování – stejná cena
Léčba přípravkem Natpar vyžaduje nastavení a zahájení léčby,
úpravu dávky a sledování
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku.
NASTAVENÍ A ZAHÁJENÍ LÉČBY PŘÍPRAVKEM NATPAR1
PŘED zahájením léčby
- Ujistěte se o dostatečném stavu zásobení 25-OH vitaminem D
- Ověřte, že sérové kalcium a magnesium jsou v referenčním rozmezí
- Dle hodnoty sérového kalcia se rozhodněte o počáteční dávce přípravku Natpar a aktivního vitaminu D
ZAHÁJENÍ léčby
Počáteční dávka přípravku Natpar: léčba se zahajuje dávkou 50 µg jednou denně subkutánní injekcí do jednoho ze stehen. Pokud je před podáním dávky sérové kalcium >2,25 mmol/l, je možné zvážit podání počáteční dávky 25 μg.
Cíl léčby:
- hladina sérového kalcia před dávkou je v rozmezí 2,0–2,25 mmol/l
- snížení nebo přerušení suplementace aktivním vitaminem D
- dostatečná suplementace kalcia
Měření požadované před zahájením léčby přípravkem Natpar
- Aktivní vitamin D: Pokud je sérové kalcium před podáním dávky > 1,87 mmol/l a pacient užívá aktivní vitamin D,
snižte jeho dávku o 50 %. - Kalcium: U pacientů, kteří užívají doplňky kalcia, udržujte jejich dávku.
ÚPRAVA DÁVKY PŘÍPRAVKU NATPAR V PRŮBĚHU LÉČBY1
I. Úprava dávky PO zahájení léčby
Kontrolní odběry v rozmezí 2–5 dnů po první aplikaci přípravku Natpar
- Změřte sérové kalcium před podáním pravidelné dávky (24 hodin po poslední aplikaci), a pokud je hladina
sérového kalcia < 1,87 mmol/l nebo > 2,55 mmol/l zopakujte měření následující den. - Upravte dávku aktivního vitaminu D nebo doplňku kalcia (nebo obou) na základě sérové hladiny kalcia a Vašeho
klinického hodnocení (tzn. příznaky hypokalcemie nebo hyperkalcemie).
II. Úprava dávky V PRŮBĚHU léčby (titrace)
Kontrolní odběry po 14–28 dnech od první aplikace přípravku Natpar
Dávka přípravku Natpar se může zvýšit o 25 µg každé 2–4 týdny, do dosažení maximální denní dávky 100 µg.
Snížení dávky na minimálních 25 µg může proběhnout kdykoli.
Pro optimalizaci léčby se doporučuje změřit hladinu sérového kalcia korigovanou na albumin 8–12 hodin po podání
přípravku Natpar (maximální hodnota). Před plánovaným zvýšením dávky přípravku Natpar je doporučeno opakované
měření hladiny sérového kalcia korigovaného na albumin před a po aplikaci přípravku Natpar.
Data z klinických studií ukazují, že u více jak poloviny pacientů léčených přípravkem Natpar je dávka upravena na maximální možnou dávku 100 µg denně.5
Natpar podávaný jednou denně zajišťuje stabilní hladinu kalcia po dobu 24 hodin1,6
Dočasné nebo trvalé přerušení léčby přípravkem Natpar musí být doprovázeno monitorováním hladiny kalcia v séru
a zvýšením exogenního kalcia a/nebo podle potřeby zdrojů aktivního vitaminu D.
DLOUHODOBÉ SLEDOVÁNÍ PACIENTA
Doporučené pravidelné sledování:7
U pacientů s chronickou hypoparatyreózou se mohou častěji vyskytnout tyto komorbidity:
Evropská endokrinologická společnost doporučuje individualizovanou léčbu a sledování7
Cílem léčby přípravkem Natpar je dosažení kontroly kalcemie, a tak snížení příznaků hypoparatyreózy společně s optimalizací parametrů kalcio-fosfátového metabolismu1,7
Cíle léčby u pacientů s chronickou hypoparatyreózou7,10
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA
programu dle instrukcí
v letáčku. Registraci je nutné
udělat v okamžiku,
kdy bude znám termín prvního
podání LP Natpar u ošetřujícího
endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem pomoci s první
samostatnou aplikací
v domácím prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA programu dle instrukcí v letáčku. Registraci je nutné udělat v okamžiku, kdy bude znám termín prvního podání LP Natpar u ošetřujícího endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace v rámci HYPOPARA programu s cílem pomoci s první samostatnou
aplikací v domácím
13. den od zahájení léčby
2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
Pro zobrazení časové osy otočte vaše mobilní zařízení