Oblast primární a sekundární imunodeficience
Při primární (vrozené) imunodeficienci (PID) se v těle nevytvářejí v dostatečné míře některé součásti imunitního systému (imunoglobuliny – Ig, T-lymfocyty, fagocyty, složky komplementu) nebo některé z nich nefungují správně. Jedná se o více než 400 chronických poruch, vznikajících v důsledku genetické vady nebo změn v lidské DNA, v jejichž důsledku může u postiženého jedince existovat zvýšená náchylnost k bakteriálním a virovým infekcím (i atypickými agens – oportunními patogeny) a také vyšší nemocnost (banálními infekcemi i pneumoniemi, sinusitidami, meningitidami a abscesy), přičemž infekce většinou špatně odpovídá na konvenční léčbu. V Evropě trpí PID cca 10 000 osob a v převážné míře se manifestuje jako deficience protilátková, případně jako deficit T-buněk (a kombinované poruchy). Tato patologie se u jedince může objevit, aniž by se PID vyskytovala v rodinné anamnéze.
Pacientovi s imunodeficitem je nutno v rámci substituční imunoglobulinové terapie podávat infuzí nebo injekčně (intravenózně či subkutánně) protilátky získané z krve zdravých jedinců. Další možností léčby je transplantace kostní dřeně či krvetvorných buněk a genová terapie.
Sekundární (získané) imunodeficience (SID) nejsou až tak vzácné jako PID. Nevznikají na podkladě genetické poruchy, nýbrž podvýživy, jiné nemoci (chronická lymfatická leukémie – CLL, mnohočetný myelom – MM) nebo intervence, dysregulací imunitního systému při napadení tkáně hostitelského organismu, často prostřednictvím složitých mechanismů (většinou u neuromuskulárního postižení), a jsou známy i jako polékové reakce (při systémové kortikoterapii, imunosupresivní léčbě a protinádorové chemoterapii či radioterapii). Iatrogenní imunosuprese se také zaznamenává v souvislosti s některými pooperačními stavy (u popálenin nebo po splenektomii). Nejčastějším projevem sekundárních imunodeficiencí jsou rekurentní infekce v oblasti dýchacích cest a trávicího traktu. Při klinických projevech hypogamaglobulinemie má léčba charakter substituční terapie imunoglobuliny.
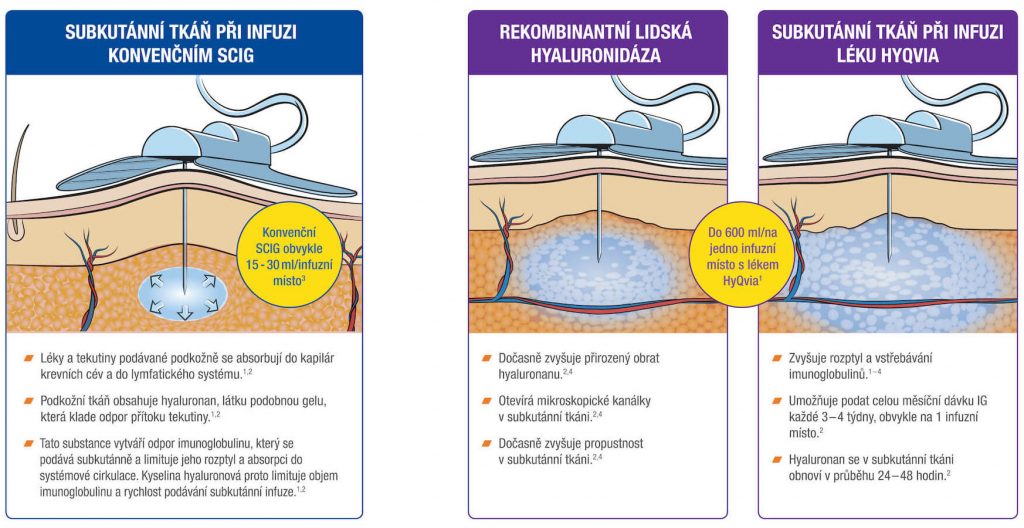
Vedle nitrožilního (i.v.) podání imunoglobulinů (IVIg) se používají také subkutánní (s.c.) aplikace (SCIg). K dispozici jsou i sofistikované produkty (facilitované přípravky – fSCIg), využívající dočasného zvýšení přirozeného obratu hyaluronanu v kůži s otevřením mikroskopických kanálků v subkutánní tkáni, což zvyšuje její propustnost.1 Podkožní podání také zvyšuje komfort léčby – současným trendem je rychlý přesun pacienta do domácího léčení a po zaškolení i domácí podávání Ig.
V této oblasti jsou Vám k dispozici tyto produkty společnosti Takeda:
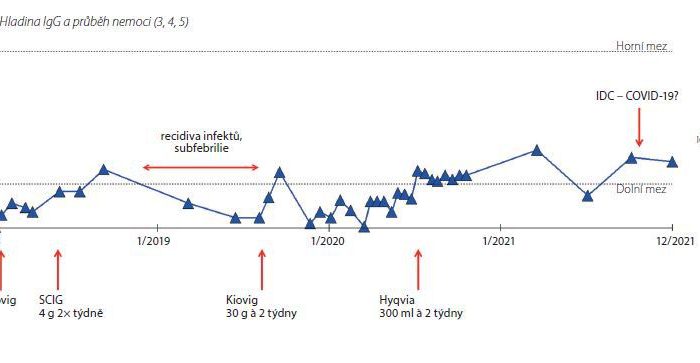
HyQvia je první a jediný SCIg s rekombinantní lidskou hyaluronidázou, která po podkožním podání zvyšuje rozptyl a vstřebávání imunoglobulinů. Má charakter facilitovaného 10% SCIg k substituční terapii dospělých, dětí i dospívajících (0–18 let), nevyžaduje žilní přístup a umožňuje podat najednou celou měsíční dávku Ig (obvykle na jednom infuzním místě). Má 93% biologickou dostupnost a režim podávání lze upravit dle léčebných potřeb pacienta. Příznivým faktem je, že při této léčbě se objevuje méně systémových nežádoucích účinků než u IVIg (8 % vs. 25 %), méně nežádoucích účinků za měsíc než u konvenčních SCIg produktů a že bylo zaznamenáno 2,97 infekcí na pacienta/rok oproti 4,51 při terapii IVIg a jen 0,025 akutních závažných bakteriálních infekcí za pacientorok. Většina (98,7 %) nežádoucích účinků byla považována za mírné nebo středně závažné.2
2 Wasserman RL, Melamed I, Stein MR, et al. Recombinant human hyaluronidase-facilitated subcutaneous infusion of human immunoglobulins for primary immunodeficiency. J Allergy Clin Immunol 2012; 130:951–957.e11.
2 Bookbinder LH, et al. J Control Release 2006;114(2):230–241.
3 Jolles S, et al. Clin Exp Immunol 2015;179:146–160.
4 Souhrn údajů o přípravku HyQvia, leden 2020.
HyQvia – facilitovaný podkožně podávaný imunoglobulin (fSCIG)

Rekombinantní lidská Ulehčuje disperzi a absorbci IgG – umožňuje podání vyššího objemu SC do místa aplikace |
 |
Normální lidský imunoglobulín 10%: Nositel terapeutického účinku |
IG terapie, která umožňuje aplikaci celé měsíční dávky*
1 jehlou na 1 infuzní místo** 1 x měsíčně a to v domácím prostředí.
Souhrn údajů o přípravku HyQvia (SPC), www.sukl.cz, Blau I-W, et al. Expert Rev Clin Immunol 2016;13:1–7.
*každé 3-4 týdny, **Frekvence infuzí může být upravena podle klinické odpovědi pacienta
Cuvitru je normální lidský imunoglobulin (SCIg) 20% s podáváním 1× týdně, který někteří pacienti preferují. Francouzská studie ukázala, že co se týká interference při léčbě, jsou pacienti s produkty pro domácí aplikaci SCIg výrazně spokojenější, než je tomu u IVIg, a jsou i spokojenější s SCIg produkty oproti substituci IVIg podávané v nemocnici.3 Potěšitelné je, že u terapie Cuvitru 2 ze 3 pacientů nevykazují lokální nežádoucí účinky a 99,8 % hodnocených infuzí bylo dokončeno bez přerušení, snížení rychlosti nebo ukončení z důvodu nesnášenlivosti.4,5 Výhodou je i to, že Cuvitru umožňuje podání do < 1 hodiny (až 60 ml/h/místo).
4 Borte M, Kriván G, Derfalvi B, et al. Efficacy, safety, tolerability and pharmacokinetics of a novel human immune globulin subcutaneous, 20%: a phase 2/3 study in Europe in patients with primary immunodeficiencies. Clin Exp Immunol 2017;187:146–159.
5 Suez D, Stein M, Gupta S, et al. Efficacy, safety, and pharmacokinetics of a novel human immune globulin subcutaneous, 20 % in patients with primary immunodeficiency diseases in North America. J Clin Immunol 2016;36:700–712.
Kiovig je normální lidský imunoglobulin 10% k infuznímu podání. Je určen k substituční a imunomodulační terapii dospělých, dětí i dospívajících (0–18 let), především u syndromů primárního imunodeficitu s poruchou tvorby protilátek, sekundárních imunodeficitů u pacientů trpících závažnými nebo opakovanými infekcemi a také například u pacientů s Kawasakiho chorobou nebo multifokální motorickou neuropatií (MMN). Jeho výhodou je 100% biologická dostupnost.
Imunoglobuliny – specifika typů terapie
 |
 |
 |
||||
|---|---|---|---|---|---|---|
| IVIG | Konvenční SCIG | Usnadněný SCIG | ||||
| Samostatné podání1,2,5 |
|
|
|
|||
| Typický počet míst podání na infuzi1,6 |
|
|
|
|||
| Objem na infuzi1,6 |
|
|
|
|||
| Frekvence infuzí1,6 |
|
|
|
|||
| Biologická dostupnost7 |
|
 |
|
 |
|
 |
| Celková doba podávání infuze za měsíc3,4,6 |
|
|
|
|||
1 Jolles S, et al. Clin Exp Immunol. 2015;179(2):146-160. 2 Jolles S. Immunotargets Ther. 2013;2:125-133. 3 Kirmse J. Home Healthc Nurse. 2009;27(2):104-111. 4 Skoda-Smith S, et al. Ther Clin Risk Manag. 2010;6:1-10. 5 HyQvia SPC. www.ema.europa.eu. 6 Wasserman RL, et al. J Allergy Clin Immunol. 2012;130(4):951-957. 7 Wasserman RL. Immunotherapy. 2014.
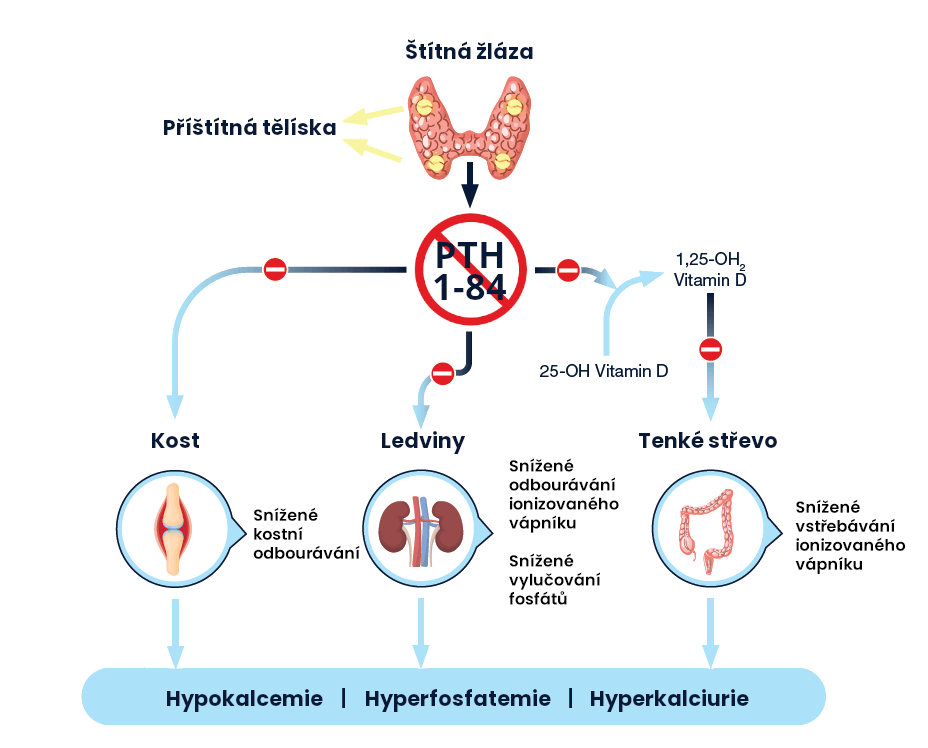
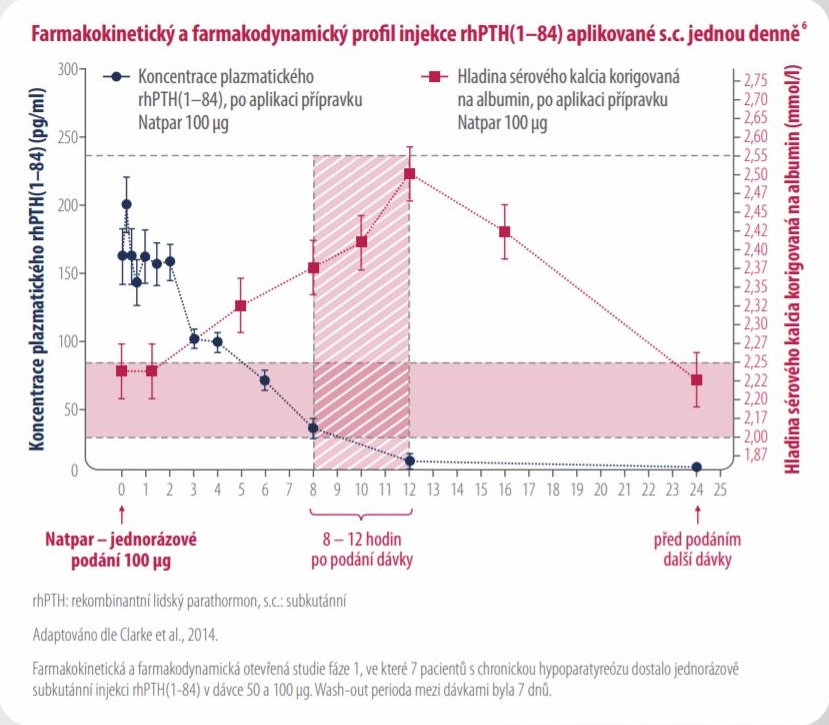
Endogenní parathormon (PTH) je vylučován příštítnými tělísky jako polypeptid z 84 aminokyselin. PTH působí prostřednictvím buněčných povrchových receptorů na parathormon, které jsou přítomné v kosti, ledvinách a nervové tkáni.
Parathormon má celou řadu zásadních fyziologických funkcí, které zahrnují jeho ústřední úlohu při regulaci hladiny kalcia a fosfátů v séru v pevně daných hladinách, regulaci vylučování kalcia a fosfátu ledvinami, aktivaci vitaminu D a udržování normálního kostního obratu.
Natpar je produkovaný E. coli pomocí rekombinantní DNA technologie a je identický s 84 aminokyselinovou sekvencí endogenního lidského parathormonu. Natpar má stejnou primární aminokyselinovou sekvenci jako endogenní parathormon a je možné předpokládat, že má stejné fyziologické účinky.
PTH (1-84) je hlavním regulátorem homeostázy kalcia v plazmě. V ledvinách zvyšuje PTH (1-84) renální tubulární reabsorpci kalcia a podporuje vylučování fosfátů. Celkový účinek PTH je zvýšení koncentrace kalcia v séru, snížení vylučování kalcia močí a nižší koncentrace fosfátů v séru.
DEFINICE PACIENTA S CHRONICKOU
HYPOPARATYREÓZOU,
který není dostatečně kontrolován samostatnou standardní léčbou a u kterého by měla být zvážena substituční léčba rhPTH (1–84).1,3
Dosažení jednoho či více následujících kritérií Vám může pomoci
identikovat nedostatečně kontrolovaného pacienta.1-4
SLEDOVANÁ KRITÉRIA
Současná léčba1-4
Denní perorální dávka převyšuje:
· 2,5 g kalcia NEBO · 1,5 µg kalcitriolu nebo 3 µg alfakalcidolu
Biochemické parametry1-4
· Nemožnost udržet optimální hladinu sérového kalcia v dolním pásmu referenčního rozmezí
případně mírně pod dolní referenční mez, bez dokumentovaných epizod hyperkalcemie
· Opakující se hyperkalciurie > 7,5 mmol/24 h u mužů a > 6,25 mmol/24 h u žen
· Snížení glomerulární filtrace (GF) < 1,0 ml/s/1,73 m² (< 60 ml/min/1,73 m²)
· Hyperfosfatemie A/NEBO kalcio-fosfátový produkt > 4,4 mmol2/l2
Život ohrožující symptomy spojené s hypoparatyreózou1
· Broncho/laryngospasmus · Arytmie · Generalizované křeče
Jiné parametry1-4
· Komorbidity jako je nefrolitiáza nebo o nefrokalcinóza dle zobrazovacích metod
· Prokazatelná klinicky závažná malabsorpce GIT
Výrazně omezená kvalita života z důvodu přítomnosti závažných symptomů hypokalcemie1-4
Před zahájením léčby přípravkem Natpar
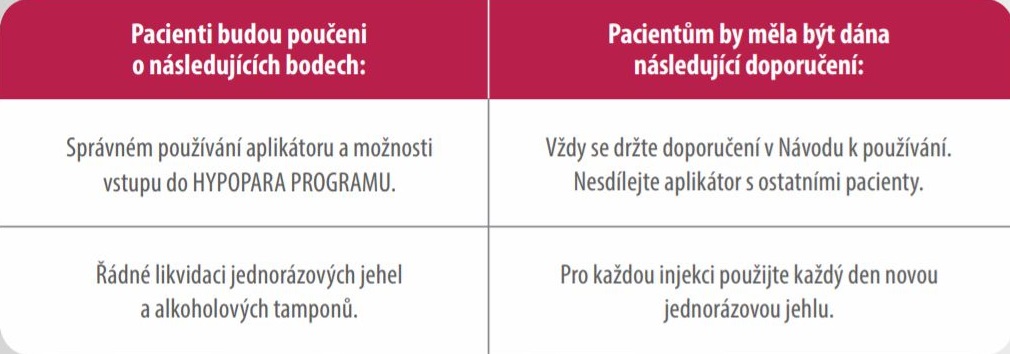
- Natpar je vhodný pro podávání samotným pacientem. Každá dávka se musí podávat jako subkutánní injekce
jednou denně, střídavě do každého stehna.1 - Pacienti musí být proškoleni předepisujícím lékařem nebo zdravotnickým odborným personálem o správném
způsobu aplikace.1
4 různá dávkování – stejná cena
Léčba přípravkem Natpar vyžaduje nastavení a zahájení léčby,
úpravu dávky a sledování
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku.
NASTAVENÍ A ZAHÁJENÍ LÉČBY PŘÍPRAVKEM NATPAR1
PŘED zahájením léčby
- Ujistěte se o dostatečném stavu zásobení 25-OH vitaminem D
- Ověřte, že sérové kalcium a magnesium jsou v referenčním rozmezí
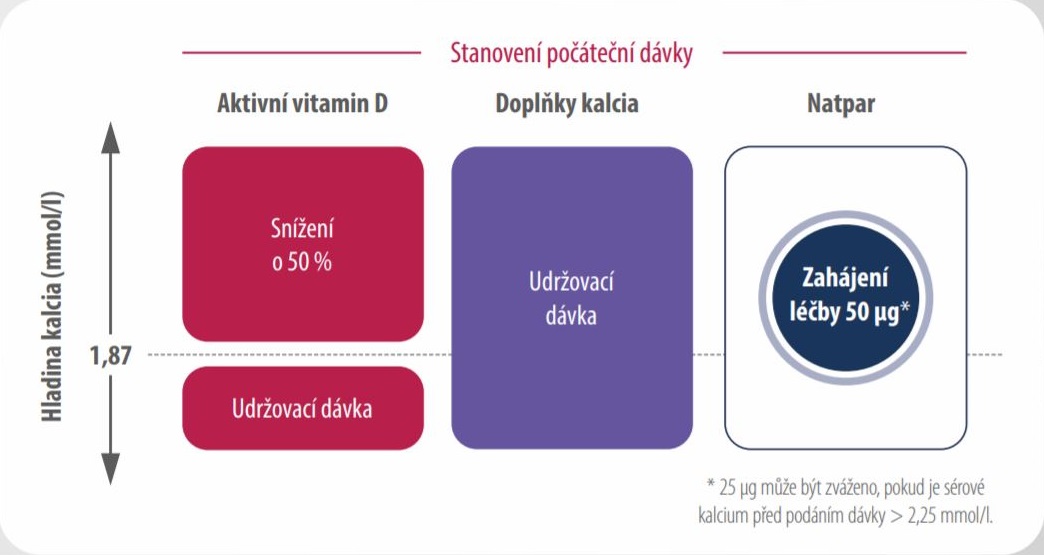
- Dle hodnoty sérového kalcia se rozhodněte o počáteční dávce přípravku Natpar a aktivního vitaminu D
ZAHÁJENÍ léčby
Počáteční dávka přípravku Natpar: léčba se zahajuje dávkou 50 µg jednou denně subkutánní injekcí do jednoho ze stehen. Pokud je před podáním dávky sérové kalcium >2,25 mmol/l, je možné zvážit podání počáteční dávky 25 μg.
Cíl léčby:
- hladina sérového kalcia před dávkou je v rozmezí 2,0–2,25 mmol/l
- snížení nebo přerušení suplementace aktivním vitaminem D
- dostatečná suplementace kalcia
Měření požadované před zahájením léčby přípravkem Natpar
- Aktivní vitamin D: Pokud je sérové kalcium před podáním dávky > 1,87 mmol/l a pacient užívá aktivní vitamin D,
snižte jeho dávku o 50 %. - Kalcium: U pacientů, kteří užívají doplňky kalcia, udržujte jejich dávku.
ÚPRAVA DÁVKY PŘÍPRAVKU NATPAR V PRŮBĚHU LÉČBY1
I. Úprava dávky PO zahájení léčby
Kontrolní odběry v rozmezí 2–5 dnů po první aplikaci přípravku Natpar
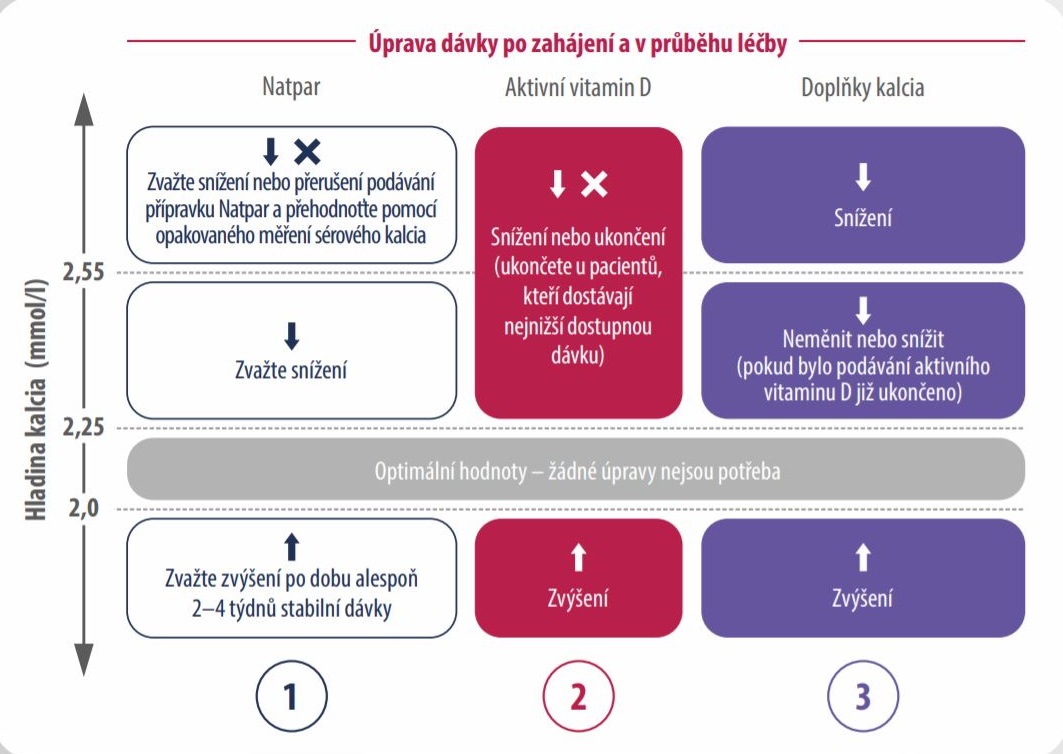
- Změřte sérové kalcium před podáním pravidelné dávky (24 hodin po poslední aplikaci), a pokud je hladina
sérového kalcia < 1,87 mmol/l nebo > 2,55 mmol/l zopakujte měření následující den. - Upravte dávku aktivního vitaminu D nebo doplňku kalcia (nebo obou) na základě sérové hladiny kalcia a Vašeho
klinického hodnocení (tzn. příznaky hypokalcemie nebo hyperkalcemie).
II. Úprava dávky V PRŮBĚHU léčby (titrace)
Kontrolní odběry po 14–28 dnech od první aplikace přípravku Natpar
Dávka přípravku Natpar se může zvýšit o 25 µg každé 2–4 týdny, do dosažení maximální denní dávky 100 µg.
Snížení dávky na minimálních 25 µg může proběhnout kdykoli.
Pro optimalizaci léčby se doporučuje změřit hladinu sérového kalcia korigovanou na albumin 8–12 hodin po podání
přípravku Natpar (maximální hodnota). Před plánovaným zvýšením dávky přípravku Natpar je doporučeno opakované
měření hladiny sérového kalcia korigovaného na albumin před a po aplikaci přípravku Natpar.
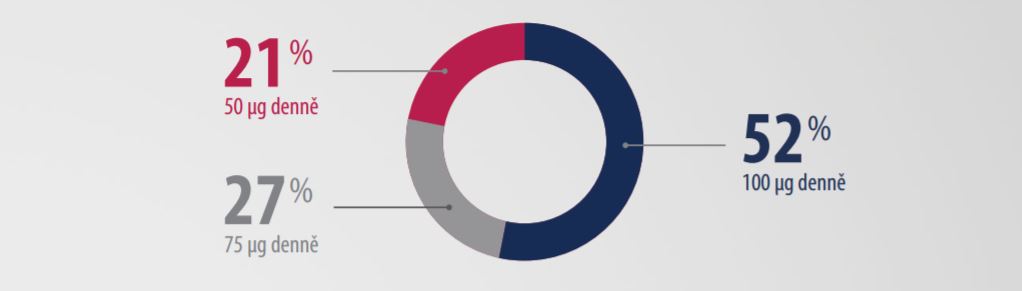
Data z klinických studií ukazují, že u více jak poloviny pacientů léčených přípravkem Natpar je dávka upravena na maximální možnou dávku 100 µg denně.5
Natpar podávaný jednou denně zajišťuje stabilní hladinu kalcia po dobu 24 hodin1,6
Dočasné nebo trvalé přerušení léčby přípravkem Natpar musí být doprovázeno monitorováním hladiny kalcia v séru
a zvýšením exogenního kalcia a/nebo podle potřeby zdrojů aktivního vitaminu D.
DLOUHODOBÉ SLEDOVÁNÍ PACIENTA
Doporučené pravidelné sledování:7
U pacientů s chronickou hypoparatyreózou se mohou častěji vyskytnout tyto komorbidity:
Evropská endokrinologická společnost doporučuje individualizovanou léčbu a sledování7
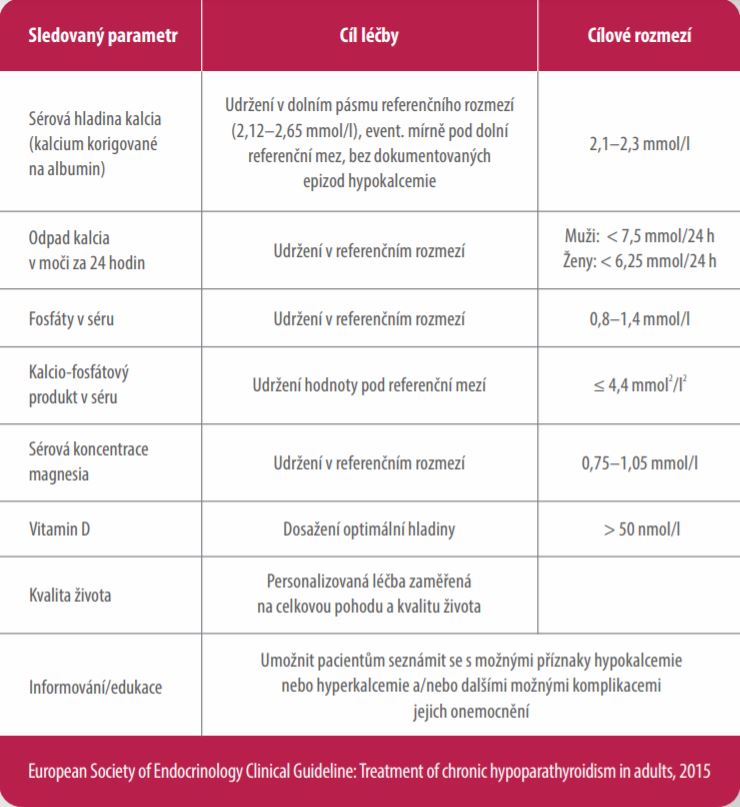
Cílem léčby přípravkem Natpar je dosažení kontroly kalcemie, a tak snížení příznaků hypoparatyreózy společně s optimalizací parametrů kalcio-fosfátového metabolismu1,7
Cíle léčby u pacientů s chronickou hypoparatyreózou7,10
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace
Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT

Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA
programu dle instrukcí
v letáčku. Registraci je nutné
udělat v okamžiku,
kdy bude znám termín prvního
podání LP Natpar u ošetřujícího
endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby
1. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem pomoci s první
samostatnou aplikací
v domácím prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA programu dle instrukcí v letáčku. Registraci je nutné udělat v okamžiku, kdy bude znám termín prvního podání LP Natpar u ošetřujícího endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace v rámci HYPOPARA programu s cílem pomoci s první samostatnou
aplikací v domácím
prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
Pro zobrazení časové osy otočte vaše mobilní zařízení
Mohlo by Vás zajímat
Endogenní parathormon (PTH) je vylučován příštítnými tělísky jako polypeptid z 84 aminokyselin. PTH působí prostřednictvím buněčných povrchových receptorů na parathormon, které jsou přítomné v kosti, ledvinách a nervové tkáni.
Parathormon má celou řadu zásadních fyziologických funkcí, které zahrnují jeho ústřední úlohu při regulaci hladiny kalcia a fosfátů v séru v pevně daných hladinách, regulaci vylučování kalcia a fosfátu ledvinami, aktivaci vitaminu D a udržování normálního kostního obratu.
Natpar je produkovaný E. coli pomocí rekombinantní DNA technologie a je identický s 84 aminokyselinovou sekvencí endogenního lidského parathormonu. Natpar má stejnou primární aminokyselinovou sekvenci jako endogenní parathormon a je možné předpokládat, že má stejné fyziologické účinky.
PTH (1-84) je hlavním regulátorem homeostázy kalcia v plazmě. V ledvinách zvyšuje PTH (1-84) renální tubulární reabsorpci kalcia a podporuje vylučování fosfátů. Celkový účinek PTH je zvýšení koncentrace kalcia v séru, snížení vylučování kalcia močí a nižší koncentrace fosfátů v séru.
DEFINICE PACIENTA S CHRONICKOU
HYPOPARATYREÓZOU,
který není dostatečně kontrolován samostatnou standardní léčbou a u kterého by měla být zvážena substituční léčba rhPTH (1–84).1,3
Dosažení jednoho či více následujících kritérií Vám může pomoci
identikovat nedostatečně kontrolovaného pacienta.1-4
SLEDOVANÁ KRITÉRIA
Současná léčba1-4
Denní perorální dávka převyšuje:
· 2,5 g kalcia NEBO · 1,5 µg kalcitriolu nebo 3 µg alfakalcidolu
Biochemické parametry1-4
· Nemožnost udržet optimální hladinu sérového kalcia v dolním pásmu referenčního rozmezí
případně mírně pod dolní referenční mez, bez dokumentovaných epizod hyperkalcemie
· Opakující se hyperkalciurie > 7,5 mmol/24 h u mužů a > 6,25 mmol/24 h u žen
· Snížení glomerulární filtrace (GF) < 1,0 ml/s/1,73 m² (< 60 ml/min/1,73 m²)
· Hyperfosfatemie A/NEBO kalcio-fosfátový produkt > 4,4 mmol2/l2
Život ohrožující symptomy spojené s hypoparatyreózou1
· Broncho/laryngospasmus · Arytmie · Generalizované křeče
Jiné parametry1-4
· Komorbidity jako je nefrolitiáza nebo o nefrokalcinóza dle zobrazovacích metod
· Prokazatelná klinicky závažná malabsorpce GIT
Výrazně omezená kvalita života z důvodu přítomnosti závažných symptomů hypokalcemie1-4
Před zahájením léčby přípravkem Natpar
- Natpar je vhodný pro podávání samotným pacientem. Každá dávka se musí podávat jako subkutánní injekce
jednou denně, střídavě do každého stehna.1 - Pacienti musí být proškoleni předepisujícím lékařem nebo zdravotnickým odborným personálem o správném
způsobu aplikace.1
4 různá dávkování – stejná cena
Léčba přípravkem Natpar vyžaduje nastavení a zahájení léčby,
úpravu dávky a sledování
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku.
NASTAVENÍ A ZAHÁJENÍ LÉČBY PŘÍPRAVKEM NATPAR1
PŘED zahájením léčby
- Ujistěte se o dostatečném stavu zásobení 25-OH vitaminem D
- Ověřte, že sérové kalcium a magnesium jsou v referenčním rozmezí
- Dle hodnoty sérového kalcia se rozhodněte o počáteční dávce přípravku Natpar a aktivního vitaminu D
ZAHÁJENÍ léčby
Počáteční dávka přípravku Natpar: léčba se zahajuje dávkou 50 µg jednou denně subkutánní injekcí do jednoho ze stehen. Pokud je před podáním dávky sérové kalcium >2,25 mmol/l, je možné zvážit podání počáteční dávky 25 μg.
Cíl léčby:
- hladina sérového kalcia před dávkou je v rozmezí 2,0–2,25 mmol/l
- snížení nebo přerušení suplementace aktivním vitaminem D
- dostatečná suplementace kalcia
Měření požadované před zahájením léčby přípravkem Natpar
- Aktivní vitamin D: Pokud je sérové kalcium před podáním dávky > 1,87 mmol/l a pacient užívá aktivní vitamin D,
snižte jeho dávku o 50 %. - Kalcium: U pacientů, kteří užívají doplňky kalcia, udržujte jejich dávku.
ÚPRAVA DÁVKY PŘÍPRAVKU NATPAR V PRŮBĚHU LÉČBY1
I. Úprava dávky PO zahájení léčby
Kontrolní odběry v rozmezí 2–5 dnů po první aplikaci přípravku Natpar
- Změřte sérové kalcium před podáním pravidelné dávky (24 hodin po poslední aplikaci), a pokud je hladina
sérového kalcia < 1,87 mmol/l nebo > 2,55 mmol/l zopakujte měření následující den. - Upravte dávku aktivního vitaminu D nebo doplňku kalcia (nebo obou) na základě sérové hladiny kalcia a Vašeho
klinického hodnocení (tzn. příznaky hypokalcemie nebo hyperkalcemie).
II. Úprava dávky V PRŮBĚHU léčby (titrace)
Kontrolní odběry po 14–28 dnech od první aplikace přípravku Natpar
Dávka přípravku Natpar se může zvýšit o 25 µg každé 2–4 týdny, do dosažení maximální denní dávky 100 µg.
Snížení dávky na minimálních 25 µg může proběhnout kdykoli.
Pro optimalizaci léčby se doporučuje změřit hladinu sérového kalcia korigovanou na albumin 8–12 hodin po podání
přípravku Natpar (maximální hodnota). Před plánovaným zvýšením dávky přípravku Natpar je doporučeno opakované
měření hladiny sérového kalcia korigovaného na albumin před a po aplikaci přípravku Natpar.
Data z klinických studií ukazují, že u více jak poloviny pacientů léčených přípravkem Natpar je dávka upravena na maximální možnou dávku 100 µg denně.5
Natpar podávaný jednou denně zajišťuje stabilní hladinu kalcia po dobu 24 hodin1,6
Dočasné nebo trvalé přerušení léčby přípravkem Natpar musí být doprovázeno monitorováním hladiny kalcia v séru
a zvýšením exogenního kalcia a/nebo podle potřeby zdrojů aktivního vitaminu D.
DLOUHODOBÉ SLEDOVÁNÍ PACIENTA
Doporučené pravidelné sledování:7
U pacientů s chronickou hypoparatyreózou se mohou častěji vyskytnout tyto komorbidity:
Evropská endokrinologická společnost doporučuje individualizovanou léčbu a sledování7
Cílem léčby přípravkem Natpar je dosažení kontroly kalcemie, a tak snížení příznaků hypoparatyreózy společně s optimalizací parametrů kalcio-fosfátového metabolismu1,7
Cíle léčby u pacientů s chronickou hypoparatyreózou7,10
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA
programu dle instrukcí
v letáčku. Registraci je nutné
udělat v okamžiku,
kdy bude znám termín prvního
podání LP Natpar u ošetřujícího
endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem pomoci s první
samostatnou aplikací
v domácím prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA programu dle instrukcí v letáčku. Registraci je nutné udělat v okamžiku, kdy bude znám termín prvního podání LP Natpar u ošetřujícího endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace v rámci HYPOPARA programu s cílem pomoci s první samostatnou
aplikací v domácím
prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
Pro zobrazení časové osy otočte vaše mobilní zařízení
Mohlo by Vás zajímat
Endogenní parathormon (PTH) je vylučován příštítnými tělísky jako polypeptid z 84 aminokyselin. PTH působí prostřednictvím buněčných povrchových receptorů na parathormon, které jsou přítomné v kosti, ledvinách a nervové tkáni.
Parathormon má celou řadu zásadních fyziologických funkcí, které zahrnují jeho ústřední úlohu při regulaci hladiny kalcia a fosfátů v séru v pevně daných hladinách, regulaci vylučování kalcia a fosfátu ledvinami, aktivaci vitaminu D a udržování normálního kostního obratu.
Natpar je produkovaný E. coli pomocí rekombinantní DNA technologie a je identický s 84 aminokyselinovou sekvencí endogenního lidského parathormonu. Natpar má stejnou primární aminokyselinovou sekvenci jako endogenní parathormon a je možné předpokládat, že má stejné fyziologické účinky.
PTH (1-84) je hlavním regulátorem homeostázy kalcia v plazmě. V ledvinách zvyšuje PTH (1-84) renální tubulární reabsorpci kalcia a podporuje vylučování fosfátů. Celkový účinek PTH je zvýšení koncentrace kalcia v séru, snížení vylučování kalcia močí a nižší koncentrace fosfátů v séru.
DEFINICE PACIENTA S CHRONICKOU
HYPOPARATYREÓZOU,
který není dostatečně kontrolován samostatnou standardní léčbou a u kterého by měla být zvážena substituční léčba rhPTH (1–84).1,3
Dosažení jednoho či více následujících kritérií Vám může pomoci
identikovat nedostatečně kontrolovaného pacienta.1-4
SLEDOVANÁ KRITÉRIA
Současná léčba1-4
Denní perorální dávka převyšuje:
· 2,5 g kalcia NEBO · 1,5 µg kalcitriolu nebo 3 µg alfakalcidolu
Biochemické parametry1-4
· Nemožnost udržet optimální hladinu sérového kalcia v dolním pásmu referenčního rozmezí
případně mírně pod dolní referenční mez, bez dokumentovaných epizod hyperkalcemie
· Opakující se hyperkalciurie > 7,5 mmol/24 h u mužů a > 6,25 mmol/24 h u žen
· Snížení glomerulární filtrace (GF) < 1,0 ml/s/1,73 m² (< 60 ml/min/1,73 m²)
· Hyperfosfatemie A/NEBO kalcio-fosfátový produkt > 4,4 mmol2/l2
Život ohrožující symptomy spojené s hypoparatyreózou1
· Broncho/laryngospasmus · Arytmie · Generalizované křeče
Jiné parametry1-4
· Komorbidity jako je nefrolitiáza nebo o nefrokalcinóza dle zobrazovacích metod
· Prokazatelná klinicky závažná malabsorpce GIT
Výrazně omezená kvalita života z důvodu přítomnosti závažných symptomů hypokalcemie1-4
Před zahájením léčby přípravkem Natpar
- Natpar je vhodný pro podávání samotným pacientem. Každá dávka se musí podávat jako subkutánní injekce
jednou denně, střídavě do každého stehna.1 - Pacienti musí být proškoleni předepisujícím lékařem nebo zdravotnickým odborným personálem o správném
způsobu aplikace.1
4 různá dávkování – stejná cena
Léčba přípravkem Natpar vyžaduje nastavení a zahájení léčby,
úpravu dávky a sledování
Před zahájením léčby přípravkem Natpar se seznamte s úplným souhrnem údajů o přípravku.
NASTAVENÍ A ZAHÁJENÍ LÉČBY PŘÍPRAVKEM NATPAR1
PŘED zahájením léčby
- Ujistěte se o dostatečném stavu zásobení 25-OH vitaminem D
- Ověřte, že sérové kalcium a magnesium jsou v referenčním rozmezí
- Dle hodnoty sérového kalcia se rozhodněte o počáteční dávce přípravku Natpar a aktivního vitaminu D
ZAHÁJENÍ léčby
Počáteční dávka přípravku Natpar: léčba se zahajuje dávkou 50 µg jednou denně subkutánní injekcí do jednoho ze stehen. Pokud je před podáním dávky sérové kalcium >2,25 mmol/l, je možné zvážit podání počáteční dávky 25 μg.
Cíl léčby:
- hladina sérového kalcia před dávkou je v rozmezí 2,0–2,25 mmol/l
- snížení nebo přerušení suplementace aktivním vitaminem D
- dostatečná suplementace kalcia
Měření požadované před zahájením léčby přípravkem Natpar
- Aktivní vitamin D: Pokud je sérové kalcium před podáním dávky > 1,87 mmol/l a pacient užívá aktivní vitamin D,
snižte jeho dávku o 50 %. - Kalcium: U pacientů, kteří užívají doplňky kalcia, udržujte jejich dávku.
ÚPRAVA DÁVKY PŘÍPRAVKU NATPAR V PRŮBĚHU LÉČBY1
I. Úprava dávky PO zahájení léčby
Kontrolní odběry v rozmezí 2–5 dnů po první aplikaci přípravku Natpar
- Změřte sérové kalcium před podáním pravidelné dávky (24 hodin po poslední aplikaci), a pokud je hladina
sérového kalcia < 1,87 mmol/l nebo > 2,55 mmol/l zopakujte měření následující den. - Upravte dávku aktivního vitaminu D nebo doplňku kalcia (nebo obou) na základě sérové hladiny kalcia a Vašeho
klinického hodnocení (tzn. příznaky hypokalcemie nebo hyperkalcemie).
II. Úprava dávky V PRŮBĚHU léčby (titrace)
Kontrolní odběry po 14–28 dnech od první aplikace přípravku Natpar
Dávka přípravku Natpar se může zvýšit o 25 µg každé 2–4 týdny, do dosažení maximální denní dávky 100 µg.
Snížení dávky na minimálních 25 µg může proběhnout kdykoli.
Pro optimalizaci léčby se doporučuje změřit hladinu sérového kalcia korigovanou na albumin 8–12 hodin po podání
přípravku Natpar (maximální hodnota). Před plánovaným zvýšením dávky přípravku Natpar je doporučeno opakované
měření hladiny sérového kalcia korigovaného na albumin před a po aplikaci přípravku Natpar.
Data z klinických studií ukazují, že u více jak poloviny pacientů léčených přípravkem Natpar je dávka upravena na maximální možnou dávku 100 µg denně.5
Natpar podávaný jednou denně zajišťuje stabilní hladinu kalcia po dobu 24 hodin1,6
Dočasné nebo trvalé přerušení léčby přípravkem Natpar musí být doprovázeno monitorováním hladiny kalcia v séru
a zvýšením exogenního kalcia a/nebo podle potřeby zdrojů aktivního vitaminu D.
DLOUHODOBÉ SLEDOVÁNÍ PACIENTA
Doporučené pravidelné sledování:7
U pacientů s chronickou hypoparatyreózou se mohou častěji vyskytnout tyto komorbidity:
Evropská endokrinologická společnost doporučuje individualizovanou léčbu a sledování7
Cílem léčby přípravkem Natpar je dosažení kontroly kalcemie, a tak snížení příznaků hypoparatyreózy společně s optimalizací parametrů kalcio-fosfátového metabolismu1,7
Cíle léčby u pacientů s chronickou hypoparatyreózou7,10
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA
programu dle instrukcí
v letáčku. Registraci je nutné
udělat v okamžiku,
kdy bude znám termín prvního
podání LP Natpar u ošetřujícího
endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem pomoci s první
samostatnou aplikací
v domácím prostředí.
13. den od zahájení léčby

2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
HYPOPARA PROGRAM
Zahájení a průběh léčby LP Natpar
Vhodný pacient

Pacient, který není
dostatečně kontrolován
samostatnou standardní
léčbou dle kritérií
schválených
Českou endokrinologickou
společností.


ZDRAVOTNICKÝ
PERSONÁL
Proškolení
zdravotnického
personálu
ke správnému
používání
pera Natpar
zástupcem
společnosti
Takeda.

Schválení léčby

Obdržení informace
o schválení léčby.
Volat pacientovi

Telefonická domluva
termínu prvního podání
LP Natpar a proškolení
správného způsobu aplikace.
Připomenout registraci
do HYPOPARA programu.
Kontrolní odběry

Před zahájením
léčby přípravkem
Natpar.
Pero Natpar

Vyzvednutí 2 ks v lékárně.
1 pero Natpar je náhradní.
1. den léčby

Edukace a aplikace

Proškolení správného
způsobu aplikace
+ první aplikace.
2–5 dnů od zahájení léčby

Kontrolní odběry

Případná úprava
dávky aktivního
vitaminu D nebo kalcia
(nebo obou).
14-28 dnů po zahájení léčby

Kontrolní odběry

Dávku přípravku Natpar
lze zvýšit o 25 µg
každé 2–4 týdny.
Snížení může
proběhnout kdykoliv.
Každých 3–6 měsíců

Kontrolní odběry

Sledování biochemických
parametrů (hladina
sérového kalcia, magnesia,
fosfátů a kreatininu, eGFR),
sledování příznaků
hypokalcemie
nebo hyperkalcemie.
1× ročně
Kontrolní odběry

Sledování
Odpadu kalcia v moči
za 24 hodin
a sledování projevů
a příznaků komorbidit.

PACIENT


Info letáček
Pacient obdrží v ordinaci lékaře
informace k účasti
v HYPOPARA programu.

Registrace do programu
Registrace do HYPOPARA programu dle instrukcí v letáčku. Registraci je nutné udělat v okamžiku, kdy bude znám termín prvního podání LP Natpar u ošetřujícího endokrinologa včetně proškolení.

Edukační balíček
Na základě registrace
do HYPOPARA programu
odeslání edukačního
balíčku na adresu pacienta
(do dvou pracovních dnů).
Obdržení edukačního balíčku
s doporučením
pečlivého prostudování
návodů k aplikaci.
2. den léčby

1. telefonická konzultace
Telefonická konzultace v rámci HYPOPARA programu s cílem pomoci s první samostatnou
aplikací v domácím
13. den od zahájení léčby
2. telefonická konzultace
Telefonická konzultace
v rámci HYPOPARA programu
s cílem připomenout postup
při smíchání nové náplně
následující den.
3 měsíce od zahájení léčby

3. telefonická konzultace
Závěrečná telefonická
konzultace v rámci
HYPOPARA programu.
Po roce léčby

Dotazník spokojenosti
Elektronický dotazník
spojenosti v rámci
HYPOPARA programu.

Exspirace pera
Automatické
upozornění na konec
exspirace pera.
Pro zobrazení časové osy otočte vaše mobilní zařízení